当前,生物安全问题已成为全人类面临的生存和发展威胁之一,特别是新冠疫情的发生,更凸显了生物安全的重要性,并引发了公众对生物安全问题(如病原微生物)的思考和关注,2021年12月31日,国家卫健委发布了《人间传染的病原微生物目录》(征求意见稿),2022年01月20日会稿截止,当前新冠疫情在全球肆虐,该目录的落地实施将对医药企业合规带来新的考验。
一、新版《人间传染的病原微生物目录》主要变化点
1)病原微生物的分类规则变化
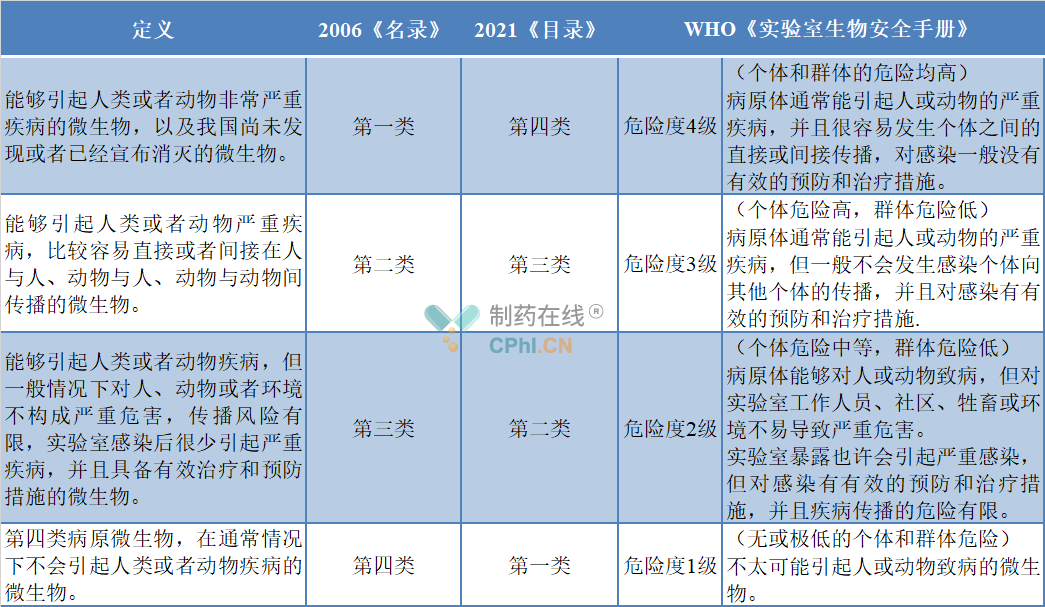
病原微生物,是指能够使人或者动物致病的微生物,包括病毒、细菌、真菌、立克次体、寄生虫等。来源:《病原微生物实验室生物安全管理条例》(2018修订版),国家根据病原微生物的传染性、感染后对个体或者群体的危害程度,在2006版《人间传染的病原微生物名录》中将人间传染的病原微生物按危害程度由高到低分为四类:第一类、第二类、第三类和第四类;而2021年12月31日国家卫健委发布《人间传染的病原微生物目录》(征求意见稿),拟将病原微生物分类与世界卫生组织发布的《实验室生物安全手册》(第三版)分类接轨,按危害程度由高到低分为第四类、第三类、第二类、第一类:
2)病原微生物的收载数量变化
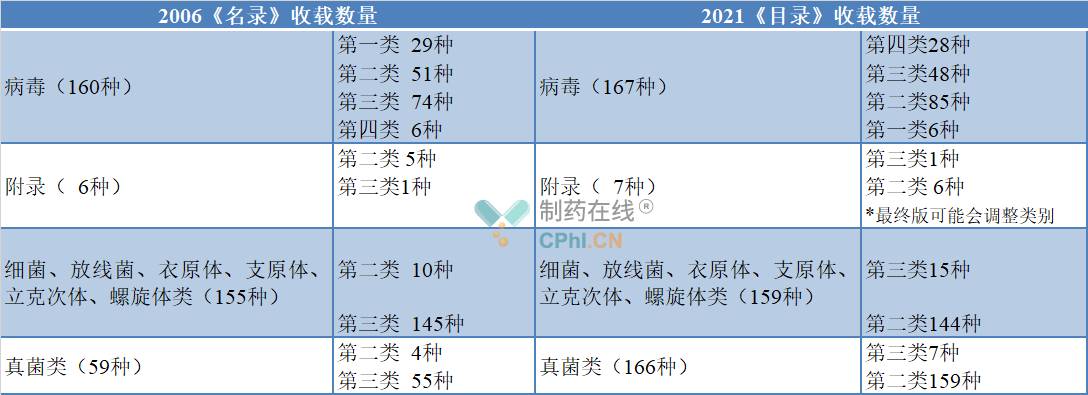
对于细菌、真菌、病毒的种类,新版《目录》也作出了调整,其中,真菌的变动最 大。2006年版《名录》中病毒为160种、附录6种,而2021年修订后《目录》病毒为167种、附录7种;2006年版《名录》中细菌、放线菌、衣原体、支原体、立克次体、螺旋体类为155种,而2021年修订后《目录》细菌、放线菌、衣原体、支原体、立克次体、螺旋体类为159种;2006年版《名录》中真菌类为59种,而2021年修订后《目录》真菌类为166种,详见下表:
二、生物制品生产活动的影响
GMP附录—《生物制品》(2020年修订版)第二十三条规定有菌(毒)操作区应当有独立的空气净化系统。来自病原体操作区的空气不得循环使用,来自危险度为二类以上病原体操作区的空气应当通过除菌过滤器排放,滤器的性能应当定期检查。法规中危险度为二类以上病原体是指在我国卫生部颁布的《中国医学微生物菌种保藏管理办法》(1985.03.23由卫生部颁布)中规定的“一类、二类”菌种和毒种。菌种的分类根据其危险性决定(包括实验室感染的可能性,感染后发病的可能性,症状轻重及愈后情况,有无致命危险及有效地防止实验室感染方法,用一般的微生物操作方法能否防止实验室感染、我国有否此种菌种及曾否引起流行、人群免疫力等情况)。依其危险程度的大小,我国的菌种分为四类,《人间传染的病原微生物目录》如落地实施,该管理办法也可能需要升级,当前定义和常见示例如下表:

三、新型冠状病毒实验活动影响
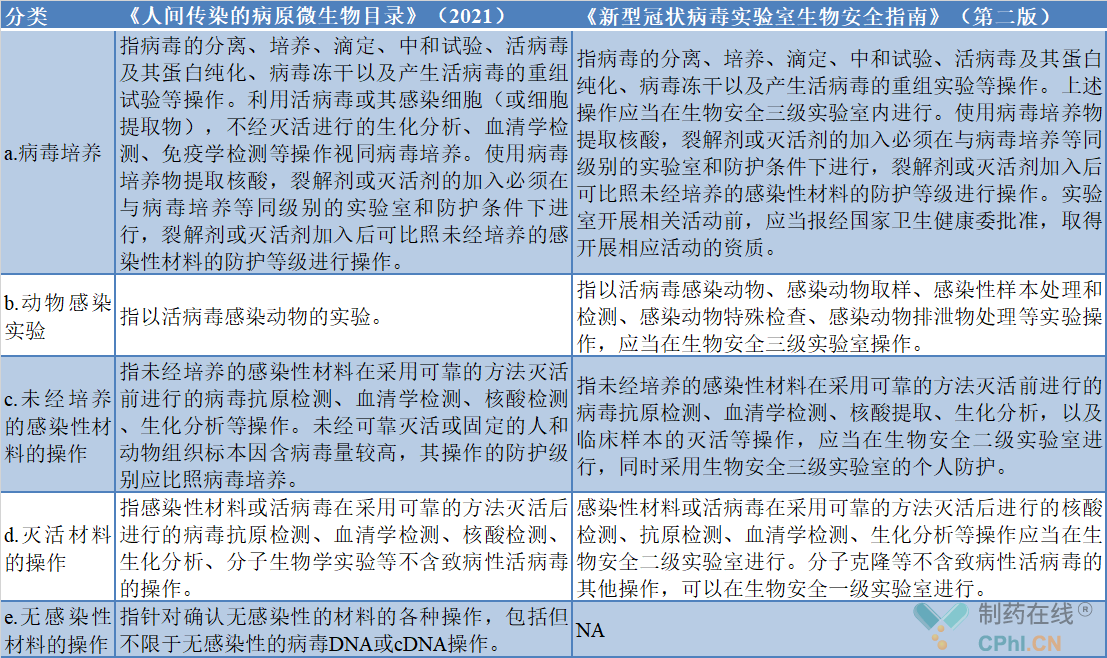
根据《微生物和生物医学实验室生物安全通用准则》(编号:WS233-2002,2003.8.1实施)要求,操作一类、二类高危病原体必须在相应生物安全防护操作间或实验室内进行,根据危险度等级,包括传染病原的传染性和危害性,国际上将生物实验室按照生物安全水平(Biosafety level,BSL)分为BSL-1实验室(P1实验室)、BSL-2实验室(P2实验室)、BSL-3实验室(P3实验室)和BSL-4实验室(P4实验室)四个等级。一般来说,相应等级实验室需要报经国家卫生健康委批准,取得开展相应活动的资质,才能开展针对某种病毒的研究。而常规高校、科研机构、企业建立的实验室设计,生物安全等级达到P2实验室即可。《人间传染的病原微生物目录》(征求意见稿)列出了2019冠状病毒为危害程度第三类病原微生物,在开展实验室和生产活动时,应参考的生物安全水平措施,与2020年1月23日,国家卫生健康委办公厅印发的《新型冠状病毒实验室生物安全指南》(第二版)基本保持一致,医药企业新冠**相关研究时应参考的生物安全水平措施如下表:
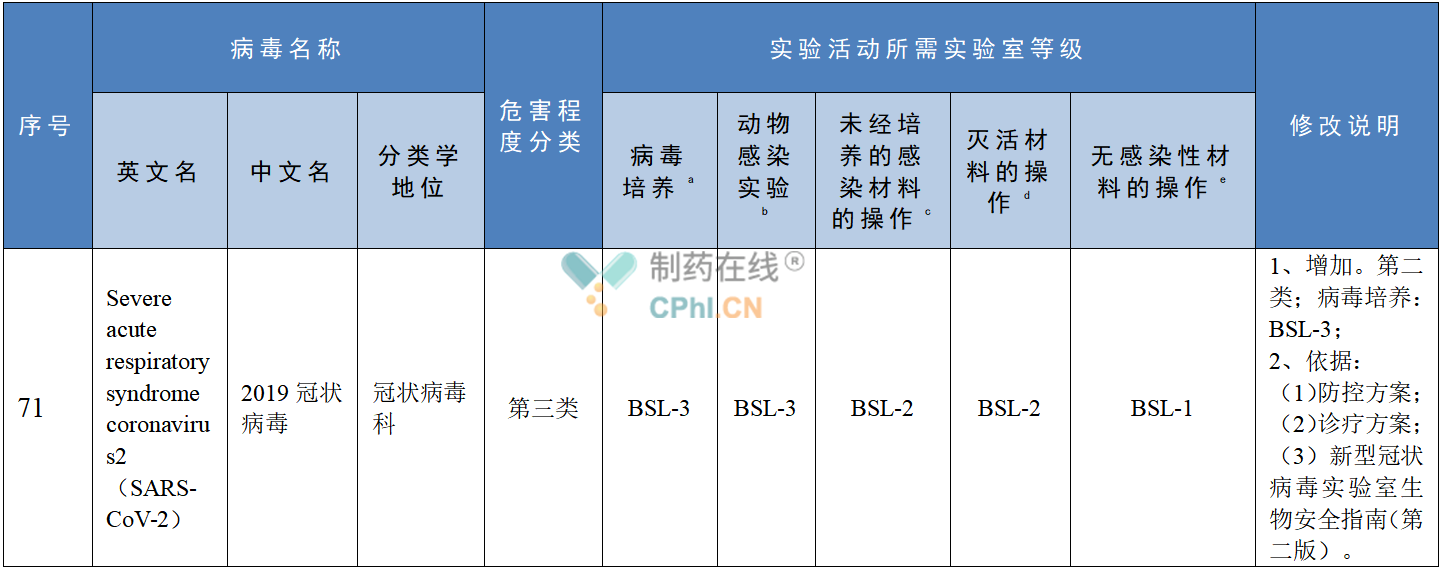
新型冠状病毒实验活动对照表
四、小结
《人间传染的病原微生物目录》的落地实施,将对从事病原微生物的研究、临床以及药品研发等起到了规范和指导作用,既可以指导相关方科学选择生物安全防护得当的实验场所从事病原微生物的检测工作,又可以对药企生物安全实验室进行筹建与验收的关键参考标准、规范,对于医药企业而言,医药企业不管是新建工厂和实验室,还是对旧厂房和生物安全实验室改造,都需要符合最新规定,并持续完善和管控生物安全,违反生物安全管理规定的,构成犯罪的,依法追究刑事责任,因此医药企业需尽早建立完善的病原微生物生物安全活动相关控制流程,做好生物安全有关工作。
参考文献
[1]国家卫生健康委员会、康利华、GMP附录《生物制品》等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57