3月14日,CDE官网显示,诺华「LNP023胶囊」拟纳入突破性治疗品种,拟定适应症为C3肾小球病(C3G)。
LNP023(Iptacopan)是一款首创口服、强效、选择性、小分子、可逆性B因子抑制剂(B因子是补体系统替代途径的关键丝氨酸蛋白酶),被开发用于治疗多种由补体驱动的肾 脏疾病(CDRD),如C3G、IgA肾病、非典型溶血性尿毒症综合征(aHUS)、膜性肾病(MN),以及罕见的血液疾病阵发性夜间血红蛋白尿(PNH)。2020年12月,该药被FDA授予治疗PNH的突破性药物资格,以及C3G的罕见儿科疾病资格(RPD)。
C3G是一种极其罕见和严重的原发性肾小球肾炎,以补体调节失调为特征,全球年发病率为百万分之1-2。C3G预后很差,约50%的患者在10年内发展为终末期肾病(ESRD),50-70%的患者在肾移植术后复发。目前,C3G还没有批准的治疗方法。
2021年11月,诺华宣布LNP023治疗C3G的2期临床研究(NCT03832114)达到主要终点。该研究是一项开放标签、2个队列、非随机2期研究,旨在评估LNP023对尚未进行肾移植的C3G患者(队列A)以及已接受肾移植且随后在移植器官中发生C3G复发的患者(队列B)的疗效、安全性、药代动力学。研究中,除了接受背景疗法外,患者还接受口服LNP023(200mg,每天2次)治疗12周。
结果显示:(1)在队列A患者(n=16)中,治疗第12周,蛋白尿相对基线显著减少45%;(2)在队列B患者(n=7)中,治疗第12周,C3蛋白沉积相对基线显著降低)。而且,2个队列在治疗12周期间均表现出强烈且持续的补体替代途径活性抑制和血清C3水平正常化。安全些方面,研究中LNP023显示出良好的安全性和耐受性,没有疑似与LNP023相关的严重不良事件。
补体是存在于血清、组织液和细胞膜表面的的一组不耐热的蛋白质,经活化后具有酶活性,共同参与人体的特异性和非特异性免疫反应。研究发现,补体参与感染、肾 脏疾病、肿瘤及自身免疫病等多种疾病的发生发展,而其激活主要通过经典途径、凝集素途径和旁路途径三条通路。其中经典途径是以抗原-抗体复合物结合C1q启动激活的途径,是抗体介导的体液免疫应答的主要效应方式;旁路途径通过微生物表面等膜性物质,从C3开始,由B因子,D因子参与激活过程,这种激活方式不依赖于特异性抗体的形成,在感染早期可为机体提供有效的防御机制;凝集素途径是甘露聚糖结合凝集素(MBL)结合至细菌启动的途径,其诱导物是机体的炎症反应急性期时蛋白产生的MBL和C反应蛋白,后者与病原体结合而启动绕过C1的MBL途径。
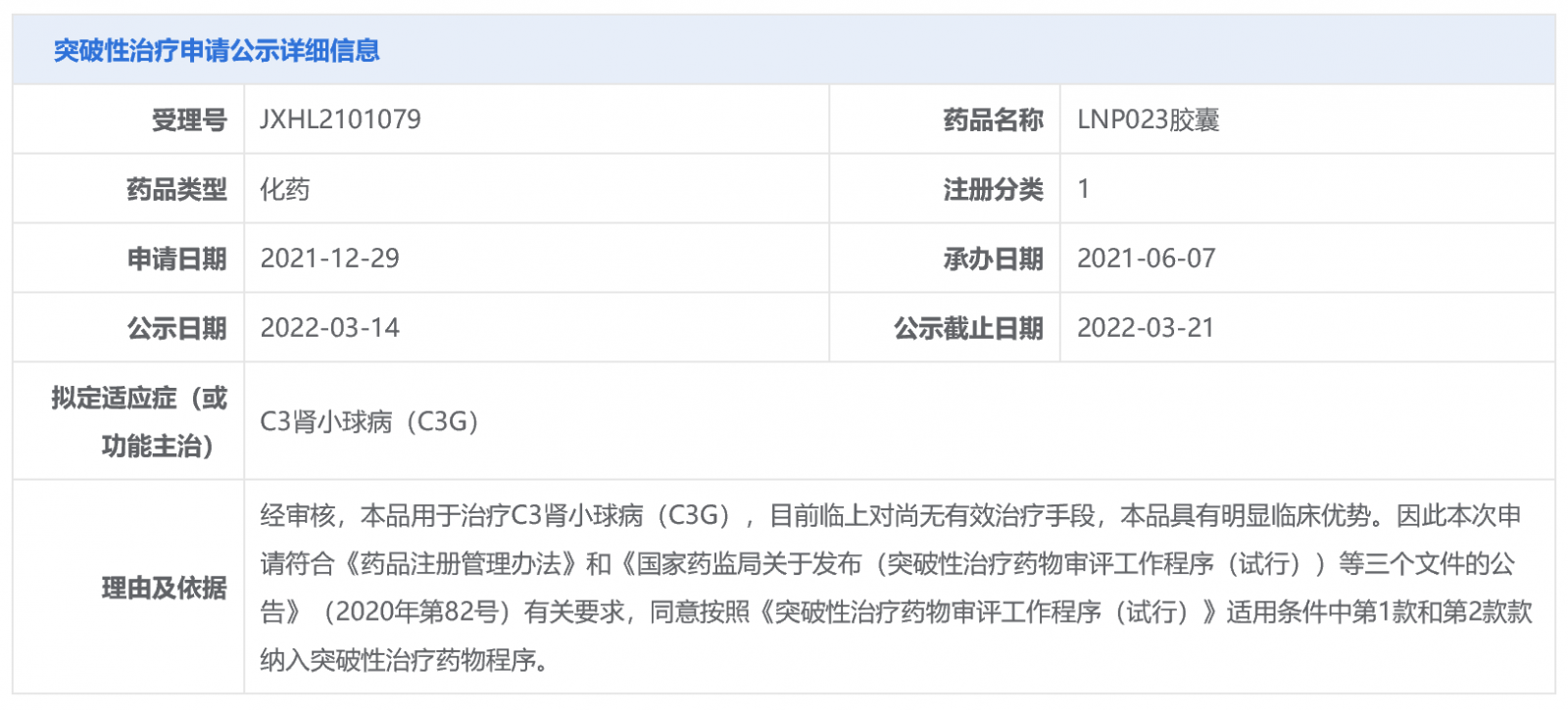
目前,全球已经批准6款补体药物(详见下表),其中仅Soliris在国内获批。Soliris和Ultomiris是Alexion公司开发的2款补体C5抑制剂,均通过抑制补体级联反应终端部分的C5蛋白发挥作用。Ultomiris是Soliris的长效版,需每4周或每8周给药一次,而Soliris每周或每2周给药一次。此外,Ultomiris治疗成人全身型重症肌无力(gMG)的sBLA正在美国进行优先审查,PDUFA日期为今年第二季度。
Empaveli是第一个且唯一一个获得监管批准的C3靶向疗法,2021年5月被FDA批准用于治疗PNH成人患者,具体为:(1)先前没有接受过治疗的PNH成人患者;(2)先前接受过C5抑制剂Soliris和Ultomiris的PNH成人患者。
Tavneos是FDA批准的首 个口服补体5a受体(C5aR)抑制剂,2021年10月被FDA批准作为一种辅助药物,联合标准疗法,用于治疗成人严重活动性抗中性粒细胞胞浆自身抗体关血管炎,具体为:肉芽肿性多血管炎(GPA)和显微镜下多血管炎(MPA)。值得一提的是,Tavneos是十年来第一个获批治疗ANCA相关血管炎的药物。
Enjaymo是一种首创的人源化单克隆抗体,经专门设计用于选择性靶向和抑制C1复合物中的丝氨酸蛋白酶C1s,2022年2月被FDA批准用于冷凝集素病(CAD)成人患者,减少因溶血导致的红细胞输注需求,成为第一个且唯一一个获批用于治疗CAD的药物。
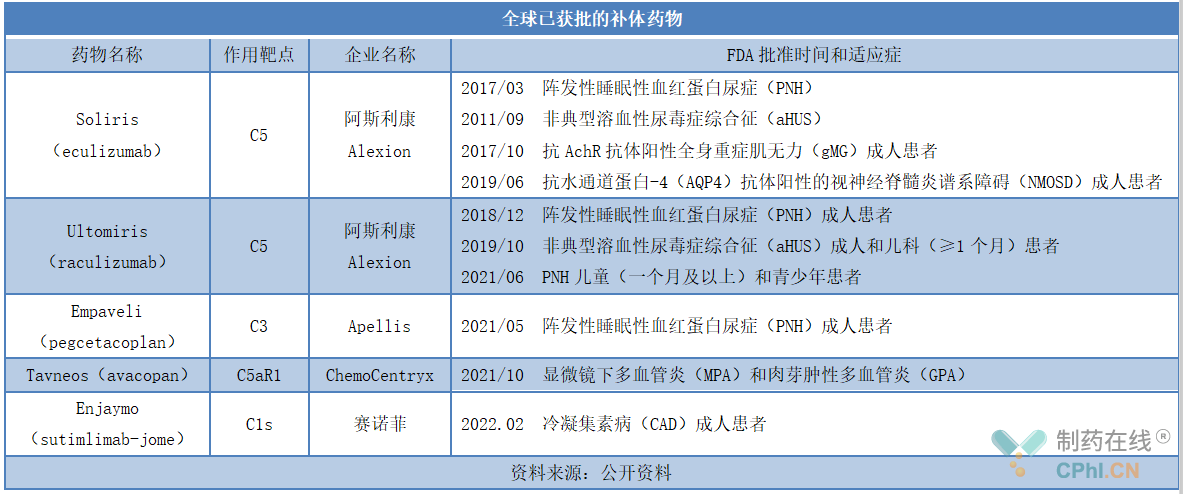
销售额上,Soliris市场表现最好,2020年销售额突破40亿美元,Ultomiris次之,2020年销售额突破10亿美元。由于2021年7月,阿斯利康完成对Alexion的收购,Soliris和Ultomiris 2021年全年销售额未公布,不过据Alexion 2021Q1财报,Soliris和Ultomiris 2021年第一季度销售额分别为1027.6百万美元和346.9百万美元,阿斯利康2021Q4财报,Soliris和Ultomiris 2021年第四季度销售额分别为1076百万美元和391百万美元,笔者推测Soliris和Ultomiris 2021年销售额还将保持增长趋势。Empaveli和Tavneos表现也不错,上市第一年销售额分别为15.1百万美元和1百万美元。
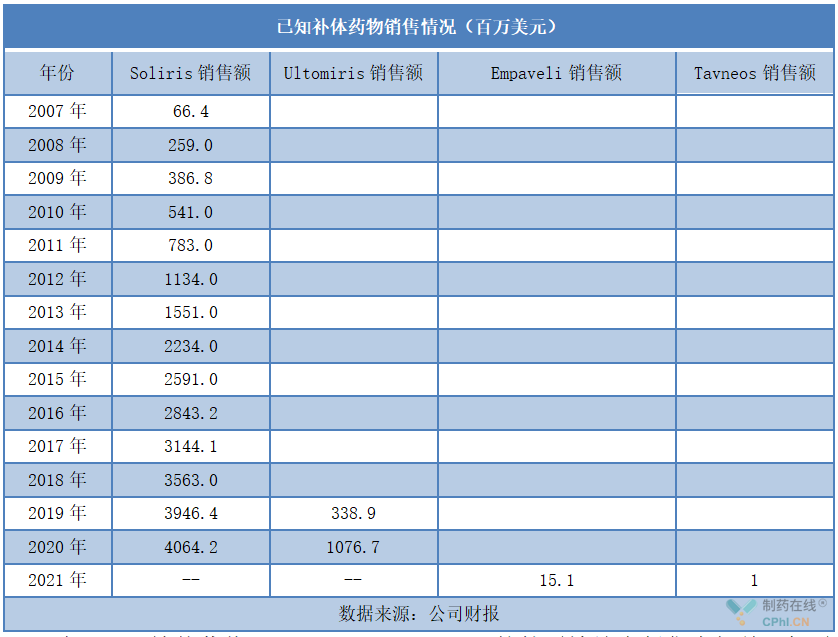
除了上述补体药物,Omeros Corporation的甘露糖结合凝集素相关丝氨酸蛋白酶2(MASP-2)靶向补体药物narsoplimab也进展较快。不过去年10月该药治疗造血干细胞移植相关血栓性微血管病(HSCT-TMA)的BLA惨遭FDA拒批。此外,narsoplimab针对IgA肾病(IgAN)和非典型溶血性尿毒症综合征(aHUS)的适应症也处于3期临床试验阶段,其中IgAN适应症被FDA授予孤儿药资格和突破性药物资格,aHUS适应症被FDA授予快速通道资格。
补体药物是药企积极布局的热门方向。除了上述提及的靶点,企业还布局了补体因子D(如Achillion Pharmaceuticals公司的danicopan)、C1q(Annexon Biosciences的ANX005)等。而且,补体药物的适应症也愈发广泛。期待,未来可以有越来越多的补体药物获批上市。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57