2022年6月24日,CDE官网发布《药物临床试验期间方案变更技术指导原则(试行)》,药物临床试验期间法规又新增一成员,自发布之日起实施,突破性地提出了临床试验期间方案变更的实际申报要求,弥补了临床试验期间方案变更监管的空白,有助于确保受试者安全,推动协调药品临床试验及上市注册进程,同时也为药品研发者提供临床期间方案变更的研发思路、方法及阶段性要求。申请人作为建立药品全生命周期的责任相关部门,应建立充分的临床试验期间相关变更风险评估和报告机制,应对《药物临床试验期间方案变更技术指导原则(试行)》等新规的落地实施。
一、临床试验期间变更政策红利助力药物研发
2020年版《药品注册管理办法》实施之前,我国临床试验期间的相关变更在政策法规层面并没有明确要求。为规范临床试验期间变更管理,满足阶段性临床试验用样品的基本要求,保护临床受试者的健康,CDE以现有国家颁布的政策法规为基础,立足国内药品注册申报现状,借鉴欧美日等发达国家/药监组织的先进管理理念,本着科学性、可操作性、前瞻性和先进性相结合原则,陆续制定了一系列临床试验期间变更管理政策,包括但不限于以下政策,如有遗漏,欢迎大家补充:

二、药物临床试验期间方案变更策略
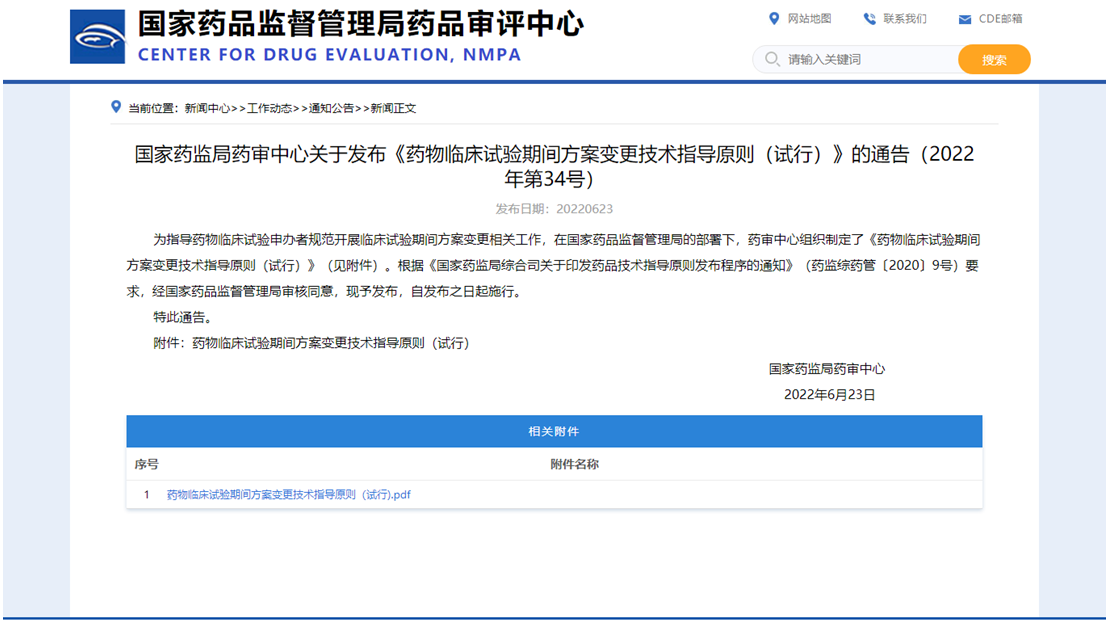
临床试验方案变更实施前,申办者应先对受试者的安全风险,以及变更试验方案的科学性等进行全面、深入的研究与评估,科学合理地判断方案变更的性质,区分实质性变更或非实质性变更,充分了解法规要求、临床设计和药物开发策略,变更路线示意图,如下图:
笔者建议研究工作可从以下几个步骤考虑变更策略:
1、方案变更实施前--评估分类
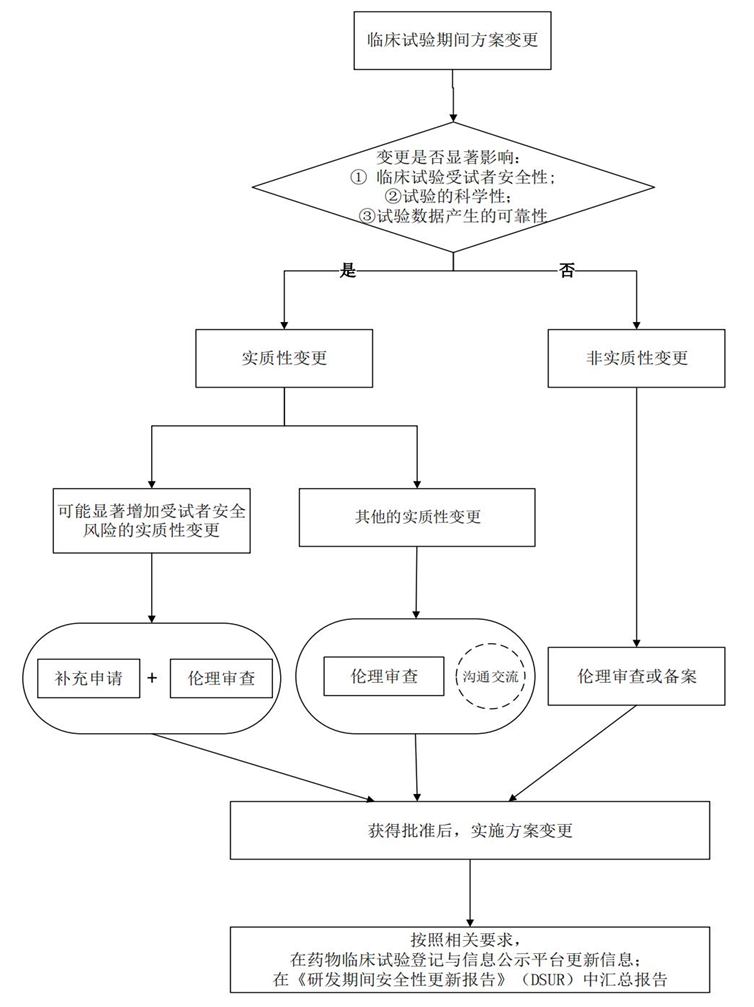
临床试验方案变更实施前,申办者应先对受试者的安全风险,以及变更试验方案的科学性等进行全面、深入的研究与评估,科学合理地判断方案变更的性质,区分实质性变更或非实质性变更,考虑到实际工作中涉及情形繁杂且差异性大,在具体临床试验方案变更中,申办者应根据具体的试验方案设计,结合非临床及药学等相关研究结果,针对变更的具体项目、变更程度和范围进行深入分析,评估在此试验中,该变更是否确实对试验安全性、科学性或数据可靠性带来显著的不利影响,为了帮助申请人更好地理解和操作,CDE发布的新规进行了举例说明,仅供参考。
(1) 评估示例:删除排除标准中"肝、肾功能异常者",但非临床安全性研究结果提示本品具有明显的肝**或肾**,综合评估认为,变更方案后的临床试验安全风险显著增加。
(2) 评估示例:修订入组标准,将病情程度由"重度"修改为"轻度",但非临床安全性研究结果和/或已知临床安全性研究结果提示本品有较大**反应,变更后受试者预期风险大于获益。
2、方案变更实施中:准备变更申请的资料要求
对于可能增加受试者安全性风险的方案变更,临床试验申办者应及时递交补充申请。根据变更的具体事项,在申办者充分进行风险评估的基础上,还应严格遵守伦理审查的相关规定和要求,必要时还应更新研究者手册、知情同意书等相关文件并报伦理委员会审查,建议从以下几个方面准备临床期间的变更方案相关的技术资料:
(1) 详细说明变更的具体内容。提供变更前、后的临床 试验方案及变更事项列表对比。
(2) 详细说明变更的必要性、科学合理性以及受试者安全风险控制等相关的依据并提供相关研究资料。
(3) 必要时,还应提供非临床、药学等相关研究资料。
(4) 必要时/如有修订,提供知情同意书、研究者手册。
(5) 必要时/如有修订,提供临床试验综述资料、药理毒理综述资料、药学综述资料。
3、方案变更实施后:
1) 申办者向药品审评机构提出补充申请或沟通交流申请。
注意事项:鼓励申请人在临床试验期间方案变更研究及评估过程中,加强与药审中心的沟通交流,有利于进一步提高工作质量和效率,建议从以下几个方面准备临床期间的变更方案相关的技术资料:
(1) 详细说明变更的具体内容。提供变更前、后的临床 试验方案及变更事项列表对比。
(2) 详细说明变更的必要性、科学合理性以及受试者安全风险控制等相关的依据并提供相关研究资料。
(3) 必要时,还应提供非临床、药学等相关研究资料。
(4) 必要时/如有修订,提供知情同意书、研究者手册。
(5) 必要时/如有修订,提供临床试验综述资料、药理毒理综述资料、药学综述资料。
2) 申办者还需要按照相关要求在药物临床试验登记与信息公示平台更新信息。
注意事项:申办者还需要按照相关要求在国家药品监督管理局药品审评中心的药物临床试验登记与信息公示平台(网址:http://www.chinadrugtrials.org.cn/index.html)更新相关信息,界面如下图。
对于药物临床试验期间方案变更,应严格遵守伦理审查的相关规定和要求,充分发挥伦理委员会的作用和职责,强化临床试验期间方案变更的风险控制。
3) 方案变更实施后,申办者还应按照相关要求在《研发期间安全性更新报告》(DSUR)中汇总报告。
DSUR报告依据:2020年版《药品注册管理办法》明确规定,药物临床试验期间,发生药物临床试验方案变更、非临床或者药学的变化或者有新发现的,申办者应当按照规定,参照相关技术指导原则,充分评估对受试者安全的影响。申办者评估认为不影响受试者安全的,可以直接实施并在研发期间安全性更新报告中报告。
参考文献
[1] www.cde.org.cn、cphi及CDE培训PPT等
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57