当前,某些药物,无法按常规思路开展临床有效性试验获得人体有效性数据申报上市。为了科学开展该类药物的有效性评价和正确应用动物法则,推动该类药物上市,2022年7月22日,国家药品监督管理局药品审评中心官网发布《基于动物法则的药物注册技术指导原则(征求意见稿)》,征求意见时限为自发布之日起1个月。该指导原则旨在为开展人体有效性试验不符合伦理或现场试验不可行的药物的动物有效性试验设计及评价提供一般性技术指导和参考,以获取科学规范的有效性试验数据支持其上市。本文为大家梳理了本指导原则中关于基于动物法则的药物注册技术考虑关键内容并结合自己的解读与大家分享。
一、什么情况下适用动物法则?
通常一个治疗用或预防用药物上市之前,需要在适用人群中开展人体临床试验获得足够的有效性和安全性数据,以证明该产品的治疗获益,并尽可能全面地暴露该产品的治疗风险。而在研发用于治疗或预防某些重大传染性疾病,和暴露于某种有害物质后产生的病症的产品时,人体临床试验存在伦理问题或者不具有操作性。为了解决这个问题,CDE起草了《基于动物法则的药物注册技术指导原则》,明确了适用范围。

二、动物法则的四个基本条件是什么?
动物法则适用于不接受治疗将会导致死亡或永 久致残的疾病,并且被严格限定于人体临床有效性试验不符合伦理或者无可行性,在FDA指南中,动物法则的具有排他性,即若可"根据FDA法规其他有效性评价标准"获得批准,则不能采用动物法则,动物法则规定,动物试验获得的数据作为支持药物临床有效性的实质性证据,需满足以下4个基本条件:
(1)致病因子的致病机制、受试药物治疗或预防的作用机制应明确;
(2)一般应在至少两种动物种属中开展有效性试验,能够从动物反应外推到人体。如果仅使用一种动物种属,则该动物模型必须充分验证、并能够很好预测人体反应;
(3)动物有效性试验的终点指标应与人体临床获益明确相关,通常是增加生存率或降低死亡率,不能仅考察替代终点;
(4)动物药效学和药代动力学试验数据,或文献资料(可能包含部分能够获得的人体数据),应足够支持人体有效剂量的选择。
三、基于动物法则的药物注册要点是什么?
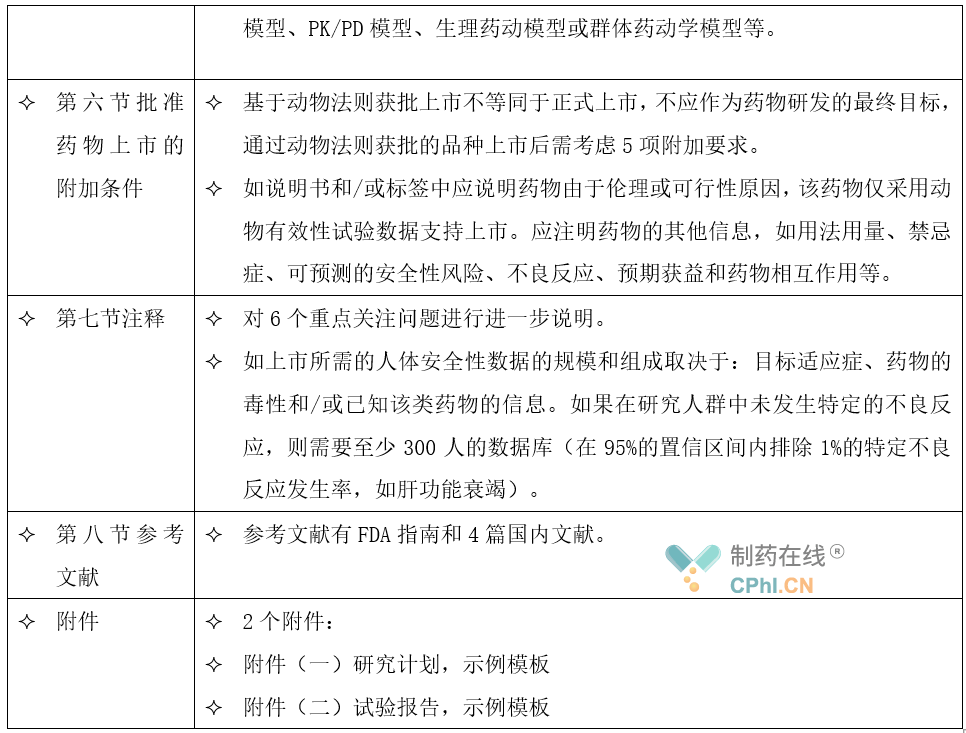
基于当前的观点和认知,基于动物法则注册药物只因不符合伦理或现场试验不可行无法开展临床有效性评价,其他研究(如安全性等)需符合现有相关指导原则技术要求,故该指导原则对该类药物的一般研发思路仅进行简要概述,重点放在有效性评价方面。本指导原则主要分为8个章节,分别为概述、动物试验的一般要求、动物模型、充分的和良好对照的动物有效性试验、外推人体有效剂量、批准药物上市的附加条件、注释及参考文献以及附件,亮点内容包括。

参考文献
[1] www.cde.org.cn.中国临床药理学杂志等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57