为了进一步加强对血液制品生产企业的监督管理,2022年9月15日,国家疫 苗检查中心暨国家药品监督管理局食品药品审核查验中心官网发布《血液制品生产现场检查指南》(征求意见稿),征求意见截止日期2022年9月30日。这是国内首部针对血液制品生产现场检查指南,也是2019年12月1日起实施史上"最严"的《疫 苗管理法》和《药品管理法》后,监管部门发布血液制品生产现场检查指南,弥补了我国对血液制品生产现场检查在法规层面和技术层面的不足,进一步完善血液制品监管长效机制。本文对《血液制品生产现场检查指南》中主要内容进行了分析。
一、血液制品监管法规政策演变
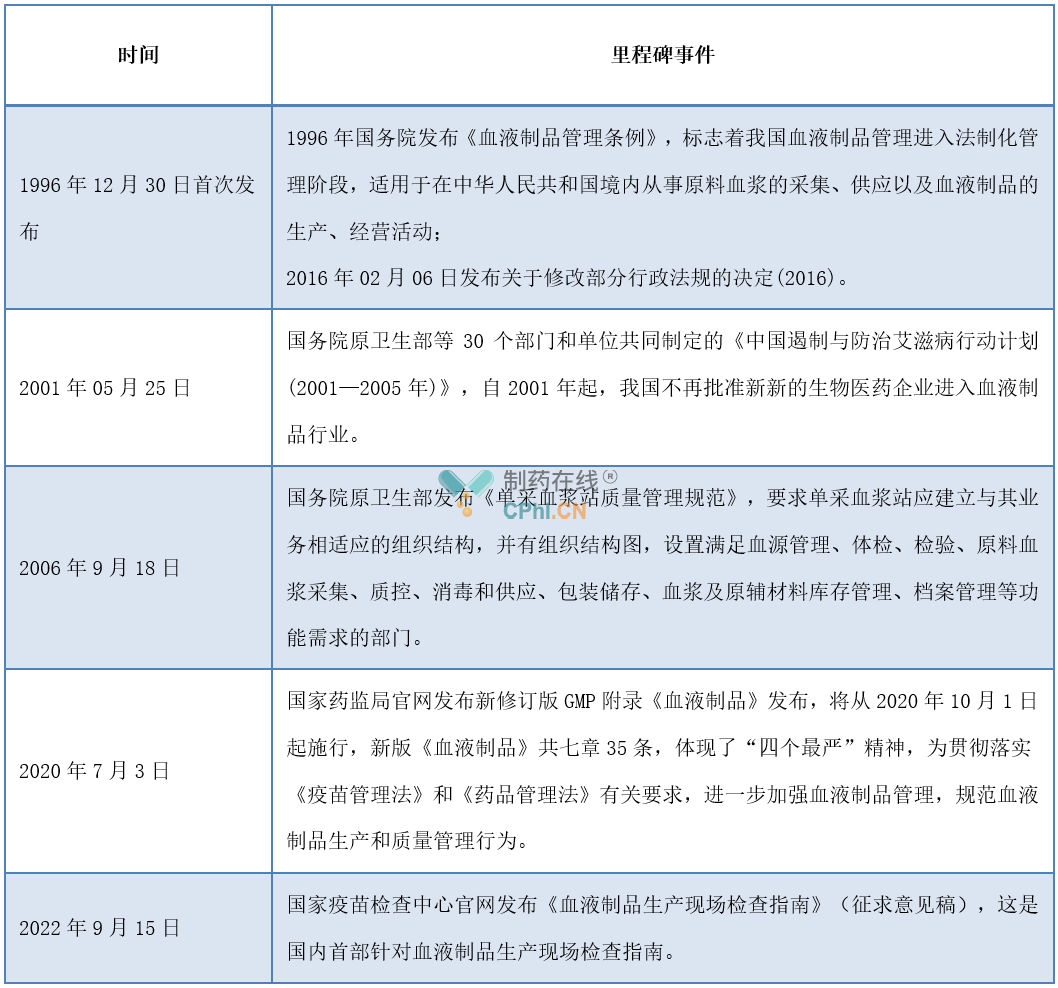
血液制品属生物制品,是一种特殊药品,关系人民群众生命健康,是国家战略性产品之一,据报道,自2001年起,我国不再批准新新的生物医药企业进入血液制品行业,我国血液制品监管法规政策是一个从无到有、不断完善、循序渐进的过程,各阶段政策法规摘录见下表:
二、血液制品存在的主要问题
血液制品系指以由健康人血浆为起始原料,经血浆合并,分离纯化等工艺制备的单一或复合型蛋白组分制品,如需制备特异性人免疫球蛋白,还需采用经批准的人用疫 苗或免疫原对健康献浆员进行主动免疫或特殊程序筛查经自然感染愈后获得免疫的献浆者,采集/收集符合要求的高效价特免血浆用于特异性人免疫球蛋白的制备。血液制品临床疗效可靠且显著,但也存在着一些潜在的不安全因素,特别是致病病毒的污染可能引起的不良后果,如人血可被污染并携带、进而经血传播的病毒,主要有乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)等几种。目前人们特别关注的是HIV、HBV和HCV这三种病毒。因为在输用未经病毒灭活处理的血液制品中,这三种病毒的感染率特别高,且危害特别严重,病毒污染是血液制品生产现场检查的重点内容,检查要点梳理见本文第四部分图表。
三、病毒灭活和/或去除工艺
血液制品主要包括人血白蛋白、人免疫球蛋白类制品、人凝血因子类产品等三大类产品。为确保血液制品的病毒安全性,各类血液制品生产工艺中须组合可有效灭活脂包膜病毒和非脂包膜病毒的病毒灭活和/或去除工艺。
1、人血白蛋白生产工艺简介
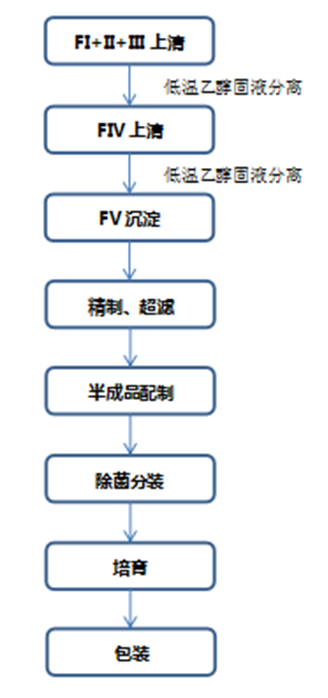
人血白蛋白系由健康人血浆,经低温乙醇蛋白分离法或经批准的其他分离法分离纯化,并经巴氏病毒灭活法加温灭活病毒后制成。含适宜稳定剂,不含防腐剂和抗生素。经典的人血白蛋白生产方法主要有Cohn6法和Kistler-Nitschman血浆蛋白分离改良法,基本分离步骤举例如下:
2、人免疫球蛋白生产工艺简介
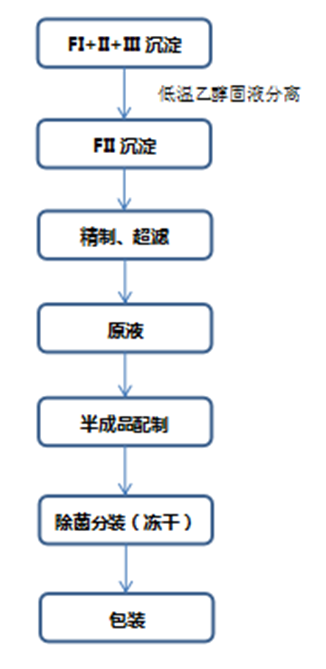
人免疫球蛋白系由健康人血浆,经低温乙醇蛋白分离法或经批准的其他分离法分离纯化,并经病毒去除和灭活处理制成。含适宜稳定剂,不含防腐剂和抗生素。经典的人免疫球蛋白生产方法主要有Cohn9法和Kistler-Nitschman血浆蛋白分离改良法,基本分离步骤举例如下:
3、人凝血因子类产品生产工艺简介
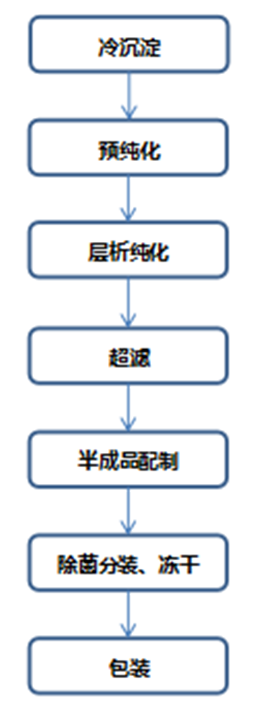
人凝血因子类产品(如人凝血因子Ⅷ(FⅧ)、人凝血酶原复合物(PCC)、纤维蛋白原(FIB)、人凝血因子IX(FⅨ)、人凝血酶等多为血浆低微含量蛋白,在血浆中维持正常的凝血功能。人凝血因子Ⅷ:FⅧ大多采用冷沉淀作为起始原料,生产过程中应有特定的去除/灭活脂包膜和非脂包膜病毒的方法,应采用多种方法联合去除/灭活病毒。人凝血因子Ⅷ生产工艺步骤举例如下:
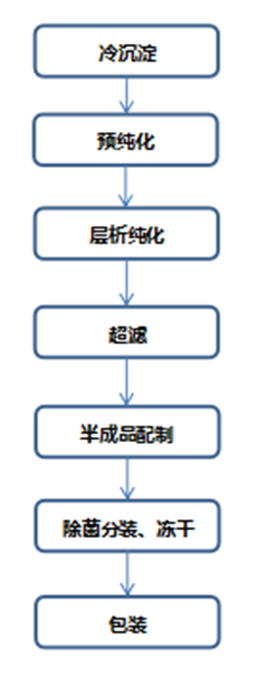
人凝血酶原复合物:人凝血酶原复合物(PCC)主要由维生素K依赖性合成的、理化性质相似的凝血酶原(FⅡ)、凝血酶转化因子(FⅦ)、抗血友病乙型因子(FⅨ)和自身凝血酶原(FⅩ)等成分组成,大多采用层析法进行制备,经S/D病毒灭活后,再经凝胶吸附去除有机溶剂/去污剂(S/D),最后经配制、除菌分装冻干、干热病毒灭活等工艺步骤制备而成。人凝血酶原复合物生产工艺步骤举例如下:
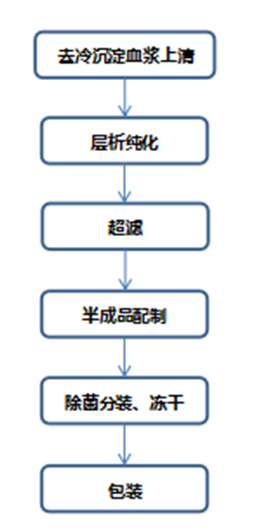
人纤维蛋白原:人纤维蛋白原制备原料通常有FI沉淀和冷沉淀两种,生产过程中应有特定的去除/灭活脂包膜和非脂包膜病毒的方法,可采用一种或多种方法联合去除/灭活病毒。人纤维蛋白原生产工艺步骤举例如下:
四、血液制品--病毒去除/灭活相关生产现场检查要点
血液制品应至少经过一步病毒去除/灭活,病毒去除/灭活生产工艺应与产品注册批准的要求一致,凝血因子类产品应采用经批准的方法去除和灭活脂包膜和非脂包胞病毒,且应按国药监注[2002]160号《血液制品去除/灭活病毒技术方法及验证指导原则》要求进行验证,血液制品去除/灭活病毒技术方法主要有巴斯德病毒灭活法、低pH孵放、纳米膜过滤法、干热病毒灭活,生产现场检查要点梳理如下:

参考文献
[1] http://www.cfdi.org.cn、《血液制品》,人民卫生出版社,2013.03



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57