2023年12月1日,周五,这个日子对于制药行业来说又多了一个戏谑的称呼--"周五布置家庭作业日"。就在这一天,国家药品监督管理局药品审评中心官网发布了一份名为《新药临床安全性评价技术指导原则》的通告(2023年第59号),该指导原则将从发布当天起至2023年12月1日起开始实施。这份指导原则针对新药(适用于化学药品和治疗用生物制品新药)上市前两个阶段安全性评价的不同侧重点,分别阐述了相应的安全性评价内容和分析评估方法。本文为大家梳理了本指导原则中新药临床安全性评价重点内容并结合自己的解读与大家分享。
一、评价新药临床安全性术语的标准化
在描述新药临床安全性评价中,使用标准术语可以确保类似的不良事件得到合理归类和合并。准确的表述不良事件并给予标准化医学编码和恰当的归类,有助于检测潜在的安全性风险信号,并便于对多项临床试验的安全性数据进行合并分析。了解这些基本概念对于理解本指导原则至关重要,有助于更好地进行药物临床安全性评价和数据合并分析,以下是药物临床试验期间安全性评价报告的几个基本概念:

二、新药临床安全性评价相关法规要求
药物临床试验过程中对药物安全性的评价是全面、客观评价一个试验药物不可或缺的重要环节。随着国内临床试验体量的不断增大,国家监管部门也在不断加大管理力度,陆续发布了多个临床试验安全评价与报告要求相关的指导原则,对规范和指导申办者在临床试验期间及上市后的不良反应监测等方面起到了积极的推动作用,主要法规梳理摘录如下:
(1) 自2020年7月1日起施行的《药物临床试验质量管理规范》(2020年第57号)中,强调了申办者在安全性信息收集、评价、递交和分发环节中的责任,也对研究者如何保障受试者安全、做好安全信息记录和评价提出了更为明确的要求,明确研究者的安全性报告应当符合以下要求:除试验方案或者其他文件(如研究者手册)中规定不需立即报告的严重不良事件外,研究者应当立即向申办者书面报告所有严重不良事件,随后应当及时提供详尽、书面的随访报告。严重不良事件报告和随访报告应当注明受试者在临床试验中的鉴认代码,而不是受试者的真实姓名、公民身份号码和住址等身份信息。试验方案中规定的、对安全性评价重要的不良事件和实验室异常值,应当按照试验方案的要求和时限向申办者报告。涉及死亡事件的报告,研究者应当向申办者和伦理委员会提供其他所需要的资料,如尸检报告和最终医学报告。研究者收到申办者提供的临床试验的相关安全性信息后应当及时签收阅读,并考虑受试者的治疗,是否进行相应调整,必要时尽早与受试者沟通,并应当向伦理委员会报告由申办方提供的可疑且非预期严重不良反应。
(2) 2021年12月1日起实施的《药物警戒质量管理规范》明确要求申办者对临床试验期间的安全风险管理承担主体责任。申办者需要全面收集药物临床试验期间的安全性信息,并进行风险监测、识别、评估和控制。这意味着申办者需要密切关注受试者的安全,及时发现并解决潜在的安全性问题。为了确保受试者的安全,申办者需要采取一系列风险控制措施。这些措施可能包括修改试验方案、暂停或终止试验、修改知情同意书等。申办者还需要评估这些风险控制措施的有效性,以确保它们能够有效地降低受试者的风险。此外,申办者还需要建立完善的安全信息收集和报告系统,以便及时发现和报告任何与试验药物相关的安全性问题。这些信息应该被记录在病例报告表中,并定期提交给伦理委员会和监管部门。
(3) 2020年7月1日施行的《药品注册管理办法》明确规定,对于药物临床试验期间出现的可疑且非预期的严重不良反应和其他潜在的严重安全性风险信息,申办者应当按照相关要求及时向药品审评中心报告。这种报告制度旨在保护受试者的安全,并确保数据的准确性和可靠性。在药物临床试验期间,如果发生药物临床试验方案的变更、非临床或药学的变化或有新发现,申办者应当按照规定,参照相关的技术指导原则,充分评估这些变化或新发现对受试者安全的影响。这种评估有助于确保药物临床试验的完整性和科学性,并为保障受试者的安全提供支持。
三、药物临床试验安全性评价的目的
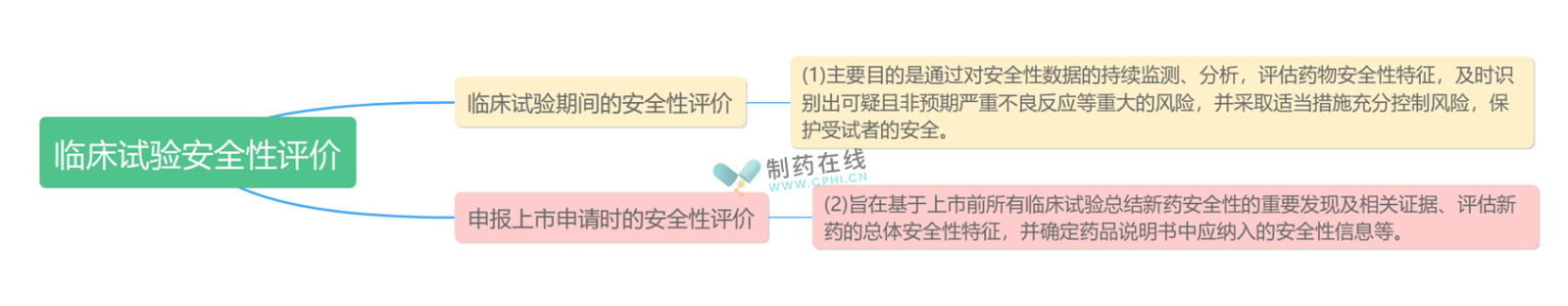
不同的临床试验安全性评价的侧重点均有不同,新药临床安全性评价是新药获益-风险评估的重要基础,应贯穿于研发和上市的全生命周期,包括临床试验期间、申报上市申请时,以及上市后的安全性评价。本指导原则针对新药上市前两个阶段安全性评价,目的如下:
[1] NMPACDECDR、广东省药学会等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57