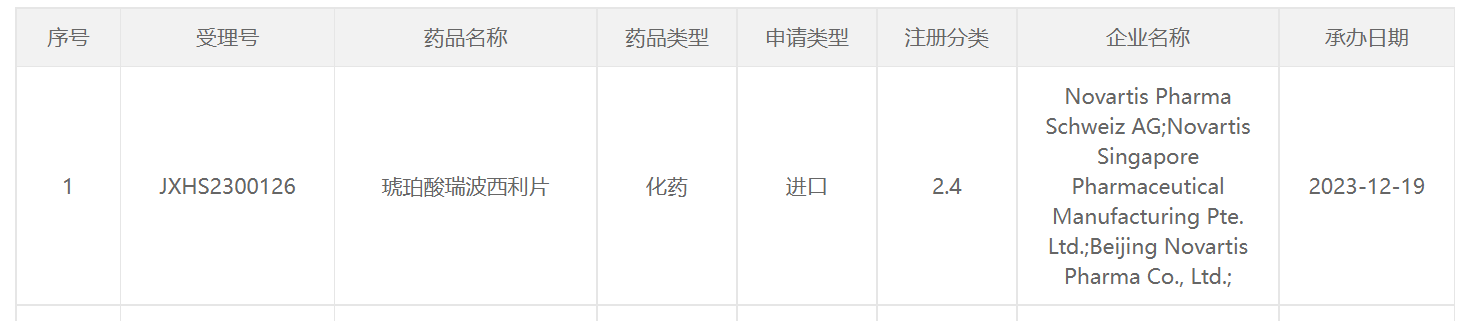
12月19日,诺华「琥珀酸瑞波西利片」在国内的2.4类注册申请获CDE受理。笔者推测此次瑞波西利申报的新适应症为:联合非甾体芳香酶抑制剂(NSAI)辅助治疗HR+/HER2-早期乳腺癌。
瑞波西利(ribociclib,Kisqali)是FDA批准的第二款CDK4/6抑制剂,2017年3月被FDA批准联合一种芳香酶抑制剂,作为一种初始内分泌疗法,用于HR+/HER2-局部晚期或转移性乳腺癌绝经后女性患者的一线治疗。随后,该药又被FDA批准用于治疗HR +/HER2-晚期或转移性女性乳腺癌患者,成为首 款联合芳香酶抑制剂治疗绝经前、围绝经、绝经后女性患者的CDK4/6抑制剂。
目前,Kisqali 已在全球99个国家/地区获批上市,2020年至2022年其销售额分别为6.87亿美元、9.37亿美元、12.31亿美元,今年前三季度其销售额为14.7亿美元。
在国内,瑞波西利于2023年1月被NMPA批准联合芳香化酶抑制剂,作为HR+/HER2-局部晚期或转移性乳腺癌绝经前或围绝经期女性患者的初始内分泌治疗,随后又于今年5月被NMPA批准联合芳香化酶抑制剂,用于HR+/HER2-局部晚期或转移性乳腺癌的初始内分泌治疗。
目前,瑞波西利已经被作为1类证据Ⅱ级推荐写入2023年《中国临床肿瘤学会乳腺癌诊疗指南2023版》。而且,瑞波西利还顺利通过医保谈判进入2023年国家医保,成为医保目录内首 个且唯一一款在HR+/HER2-晚期乳腺癌一线治疗领域取得无疾病进展生存(PFS)、总生存期(OS)和生活质量三重显著获益的CDK4/6抑制剂。
除了治疗晚期乳腺癌,瑞波西利还被开发用于治疗早期乳腺癌,其治疗HR+/HER2-早期乳腺癌的3期临床研究NATALEE在中期分析中达到主要终点。NATALEE研究是一项随机、开放标签、全球多中心试验,旨在评估瑞波西利联合内分泌对比内分泌辅助治疗HR+/HER-2早期乳腺癌的疗效和安全性。
NATALEE研究共纳入来自20个国家/地区的5101例具有复发风险的Ⅱ-Ⅲ期HR+/HER2-早期乳腺癌患者,研究中患者按1:1随机分为两组,分别接受瑞波西利(400mg/天,给药3周+停药1周,持续3年)+内分泌治疗(来曲唑2.5 mg/天或阿那曲唑1mg/天,持续≥5年,男性和绝经前女性同时接受戈舍 瑞林治疗)或单独内分泌治疗。
第46届圣安东尼奥乳腺癌研讨会(SABCS)上公布的最新数据显示:与单独使用内分泌治疗相比,瑞波西利联合内分泌治疗显示出显著的无浸润性疾病生存(iDFS)获益,瑞波西利联合内分泌治疗组和内分泌治疗组3年的iDFS率分别为90.7%和87.6%。而且,在所有患者亚组中,包括淋巴结阴性、Ⅱ期或Ⅲ期疾病患者,均观察到一致的获益。
此外,OS数据还不成熟,瑞波西利联合内分泌治疗组和内分泌治疗组分别发生84例(3.3%)和88例(3.4%)OS总事件,详见下表。安全性方面,试验中未观察到新的安全事件发生,其中19.5%的患者因不良事件而停药。

乳腺癌已超过肺癌成为全球第一大肿瘤。据GLOBOCAN数据库,2020年全球新发乳腺癌2261419例,占总体癌症发病的11.7%,其中我国2020年新发乳腺癌病例高达41.6万,发病率呈逐年递增趋势。超90%的乳腺癌患者可以在早期阶段被诊断,其中70%为HR+/HER2-乳腺癌。
内分泌治疗是HR+/HER2-早期乳腺癌最为重要的治疗手段,但约30%的高危患者会出现复发转移,进展为无法治愈的转移性乳腺癌,而且患者术后5年内的复发风险是其他非高危患者3倍。
CDK4/6抑制剂是HR+/HER2-晚期乳腺癌治疗领域的新星,其联合内分泌治疗已成为HR+/HER2-晚期乳腺癌的一线标准治疗方案 。不过,CDK4/6抑制剂在HR+/HER2-早期乳腺癌的治疗潜力也已经显现。目前,全球仅礼来的CDK4/6抑制剂Verzenio(abemaciclib,阿贝西利)于2021年10月被FDA批准联合内分泌疗法(他莫昔芬或芳香化酶抑制剂),辅助治疗HR+/HER2-、淋巴结阳性、高复发风险的早期乳腺癌患者,2023年3月又被FDA批准联合内分泌治疗法(他莫昔芬或芳香化酶抑制剂),用于HR+/HER2-、淋巴结阳性,复发风险高的早期乳腺癌患者。
在国内,阿贝西利最于2021年12月被NMPA批准联合内分泌治疗(他莫昔芬或芳香化酶抑制剂),用于HR+/HER2-、淋巴结阳性,高复发风险且Ki-67≥20%早期乳腺癌成人患者的辅助治疗。2023年9月,阿贝西利又被NMPA批准联合内分泌治疗(他莫昔芬或芳香化酶抑制剂),用于HR+/HER2-、淋巴结阳性、高复发风险的早期乳腺癌成人患者的辅助治疗。值得一提的是,目前阿贝西利治疗早晚期乳腺癌的适应症均已被纳入2023年国家医保。
Lancet Oncology杂志上发表的阿贝西利联合标准辅助内分泌治疗高危HR+/HER2-早期乳腺癌的3期研究MonarchE的数据显示:中位随访42月,与单独内分泌治疗相比,联合阿贝西利治疗可显著改善入组患者的IDFS和DRFS,联合治疗组与单独内分泌组的4年IDFS率分别为85.8%、79.4%,绝 对获益6.4%。4年DRFS率分别为88.4%、82.5%,绝 对获益5.9%。
此外,恒瑞医药的CDK4/6抑制剂达尔西利也被开发用于治疗HR+/HER2-早期乳腺癌。2023 SABCS上公布的达尔西利联合来曲唑用于HR+早期乳腺癌新辅助治疗的单臂、多中心研究DARLING-01的数据显示:在经评估的患者中,8周时的客观缓解率(ORR)为35.5%(11/31),16周时的ORR为51.7%(15/29)。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57