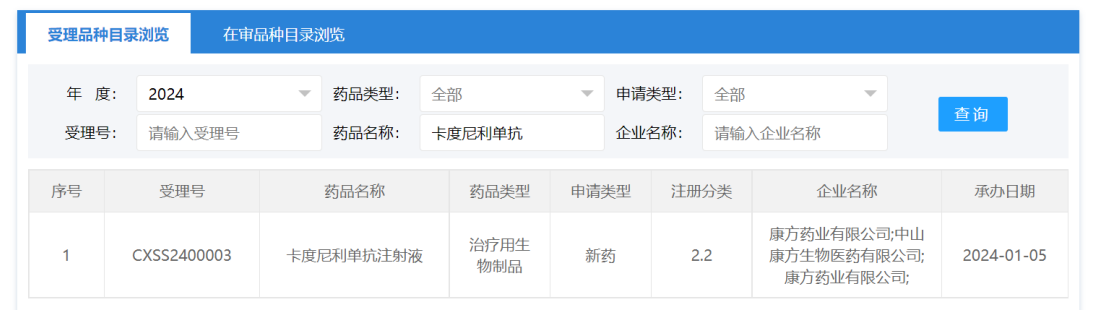
1月5日,康方生物「卡度尼利单抗注射液」的2.2类注册申请获CDE受理。卡度尼利单抗(Candonilimab,研发代号:AK104)是全球首 款获批的PD-1/CTLA-4双特异性抗体,2022年6月在国内被NMPA批准用于治疗既往接受过含铂化疗治疗失败的复发或转移性宫颈癌,商品名:开坦尼。
相关临床研究数据显示:卡度尼利单抗与PD-1单抗联合CTLA-4单抗的联合疗法相比,毒性显著降低,具有明显的安全性和疗效优势。目前,卡度尼利单抗已被《中国临床肿瘤学会(CSCO)宫颈癌诊疗指南(2022)》、《妇科肿瘤免疫检查点抑制剂临床应用指南(2023版)》和卫健委《新型抗肿瘤药物临床应用指导原则(2022年版)》作为晚期宫颈癌免疫治疗重要推荐方案,并被纳入《肝细胞癌免疫联合治疗多学科中国专家共识(2023版)》。
据公开资料,卡度尼利单抗价格为13220元/瓶(125mg)。按照“3+2”救助方案,卡度尼利单抗年治疗费用不高于19.8万元人民币。高昂的治疗费用或成为卡度尼利单抗开拓市场的阻碍,不过卡度尼利单抗市场表现不错,2022年上市后6个月的销售额就达到5.46亿元,2023上半年销售额涨至6.058亿元。遗憾的是,2023年医保谈判卡度尼利单抗再次未能成功入围。
据CDE药物临床试验登记与信息公式平台,卡度尼利单抗登记了超30项临床试验,适应症涉及晚期肝细胞癌、局部晚期或转移性非小细胞肺癌、广泛期小细胞肺癌、局部晚期不可切除或转移性高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)实体瘤、非角化性分化型或未分化型鼻咽癌、复发或难治外周 T 细胞淋巴瘤、晚期或转移性胃腺癌或胃食管结合部腺癌、外阴癌等。
治疗宫颈癌方面,除了二线治疗,卡度尼利单抗一线治疗宫颈癌的临床试验AK104-303也已取得成功。该研究是一项随机、双盲、安慰剂对照3期研究,旨在评估卡度尼利联合含铂化疗+/-贝伐珠单抗对比安慰剂联合含铂化疗+/-贝伐珠单抗一线治疗持续、复发或转移性宫颈癌的有效性和安全性。2023年11月,康方生物宣布AK104-303研究达到由独立中心影像评估(BICR) 基于 RECIST v1.1 评估的无进展生存期(PFS)的主要研究终点:与安慰剂联合含铂化疗+/-贝伐珠单抗相比,卡度尼利联合含铂化疗+/-贝伐珠单抗在PFS有统计学显著改善(全人群,即无论PD-L1表达,包含PD-L1 CPS≥1人群以及PD-L1 CPS<1人群)。不过,该研究另一主要研究终点OS尚未达到事件数,未做正式的统计分析,但已显示OS改善趋势。
此外,卡度尼利单抗治疗胃癌方面也已取得不错进展。2023年11月,康方生物宣布卡度尼利单抗联合奥沙利铂和卡培他滨 (XELOX) 对比安慰剂联合 XELOX 一线治疗不可手术切除的局部晚期或转移性胃腺癌或胃食管结合部腺癌(GC/GEJC)的3期临床研究AK104-302在期中分析中达到主要研究终点:卡度尼利联合化疗对比安慰剂联合化疗显著延长了全人群(无论PD-L1表达)患者的OS,达到预设的优效性标准。
笔者推测此次卡度尼利单抗申报的适应症为:联合奥沙利铂和卡培他滨 (XELOX)一线治疗不可手术切除的局部晚期或转移性胃腺癌或胃食管结合部腺癌(GC/GEJC)。
胃癌是全球第五大高发癌症和第四大癌症死亡原因,2020年全球约有近110万确诊病例,76万死亡病例。胃癌早期症状不典型,超70%患者确诊时已发展为晚期,约90-95%胃癌是腺癌。而胃食管结合部腺癌是一种起源于并跨越食管与胃连接区域的胃癌。据不完全统计,在过去的一年,局部晚期或转移性胃腺癌或胃食管结合部腺癌(GC/GEJC)一线治疗取得不错进展。
●2023年2月,百济神州PD-1单抗替雷利珠单抗(百泽安)被NMPA正式批准,联合氟尿嘧啶类和铂类药物化疗用于PD-L1高表达的局部晚期不可切除的或转移性的胃或胃食管结合部腺癌(G/GEJ)的一线治疗。而且该适应症已被纳入2023年国家医保。
●同月,基石药业舒格利单抗联合化疗一线治疗不可手术切除的局部晚期或转移性胃/胃食管结合部腺癌的新适应症上市申请获CDE受理。舒格利单抗是一款抗PD-L1单克隆抗体,目前已获批多个适应症:联合化疗一线治疗转移性IV期无驱动基因非小细胞肺癌(NSCLC);治疗同步或序贯放化疗后未出现疾病进展的、不可切除、III期NSCLC;复发或难治性结外NK/T细胞淋巴瘤;一线治疗不可切除的局部晚期、复发或转移性食管鳞癌。
已公布的舒格利单抗联合化疗一线治疗局部晚期或转移性胃/胃食管结合部腺癌的注册性临床研究GEMSTONE-303数据显示:与安慰剂联合化疗的对照组相比,舒格利单抗联合化疗显著改善研究者评估的PFS(舒格利单抗组中位PFS为7.6个月,安慰剂组为6.1个月)。而且,舒格利单抗联合化疗可显著改善患者的OS(舒格利单抗组中位OS为14.6个月,而安慰剂组为12.5个月)。
●2023年7月和8月,安斯泰来佐妥昔单抗一线治疗Claudin18.2阳性、HER2阴性局部晚期不可切除或转移性胃或胃食管交界处腺癌的上市申请先后获FDACDE受理。佐妥昔单抗是一款靶向Claudin18.2的IgG1单克隆抗体。
已公布的佐妥昔单抗(Zolbetuximab)联合mFOLFOX6(奥沙利铂、亚叶酸 + 氟尿嘧啶联合方案)一线治疗Claudin18.2阳性、HER2阴性局部晚期不可切除或转移性胃或胃食管交界处腺癌的SPOTLIGHT研究结果显示:与安慰剂+mFOLFOX6相比,Zolbetuximab+mFOLFOX6可显著改善患者的PFS和OS。具体数据为:与安慰剂组,Zolbetuximab+mFOLFOX6组疾病进展或死亡风险降低24.9%,达到主要研究终点。而且,Zolbetuximab+mFOLFOX6组患者PFS和OS也延长(mPFS 10.61个月vs 8.67个月;mOS 18.23个月vs 15.54个月)。
此外,已公布的佐妥昔单抗(Zolbetuximab)联合CAPOX(卡培他滨+奥沙利铂联合方案)一线治疗Claudin 18.2 阳性、HER2阴性局部晚期不可切除或转移性胃癌或胃食管交界处腺癌的GLOW研究数据显示:与安慰剂+CAPOX组相比,Zolbetuximab+CAPOX组的中位PFS显著延长(8.21个月vs 6.80个月),疾病进展或死亡风险降低31.3%。而且,与安慰剂+CAPOX组相比,Zolbetuximab+CAPOX组的中位OS显著延长(14.39个月vs 12.16个月),死亡风险降低22.9%。此外,Zolbetuximab+CAPOX组的ORR和完全缓解(CR)率均高于安慰剂+CAPOX组(53.8% vs 48.8%;3.1% vs 1.5%),两组中位DoR分别为6.28个月和6.18个月。
●2023年10月,奥赛康的ASKB589注射液获NMPA批准开展3期临床试验,评价ASKB589或安慰剂联合CAPOX(奥沙利铂和卡培他滨)及PD-1抑制剂一线治疗CLDN18.2 阳性的不可切除的局部晚期、复发性或转移性胃及食管胃交界处腺癌患者的有效性和安全性。
ASKB589是奥赛康自主研发的ADCC增强型第二代抗CLDN18.2人源化单克隆抗体。2023 IGCC上口头汇报的ASKB589治疗实体瘤的多中心1/2期试验结果显示:在ASKB589临床2期扩组研究中,有可测量病灶且至少有过一次治疗后肿瘤评估的具CLDN18.2中高表达的患者接受了6mg/kg和10mg/kg的ASKB589联合CAPOX治疗,经研究者确认的客观缓解率(cORR)为79.2%, 疾病控制率(DCR)达95.8%。
●2023年12月,默沙东PD-1单抗帕博利珠单抗(商品名:可瑞达)被NMPA批准联合含氟尿嘧啶类和铂类药物化疗,一线治疗局部晚期不可切除或转移性HER2-阴性胃或胃食管结合部腺癌。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57