药品检验中标准物质的使用至关重要,因为它们的准确性和可靠性直接影响到药品检验结果的可靠性和一致性。根据《药品管理法》的规定,药品必须符合国家药品标准。这意味着所有上市销售的药品都必须满足国家规定的标准和质量要求。如果经国务院药品监督管理部门核准的药品质量标准高于国家药品标准,那么药品应当按照经核准的药品质量标准执行。这是因为更高的标准可以为公众提供更好的药品质量和安全性保障。同时,如果市场上存在没有国家药品标准的药品,这些药品也必须符合经核准的药品质量标准,以确保公众用药的安全有效。2023年12月22日,中国食品药品检定研究院(以下简称中检院)官网发布了关于公开征求《国家药品标准物质管理办法(草案)》意见的通知,会稿截止日期:2024年1月20日,这是历时12年之后对2011年发布实施《国家药品标准物质管理办法》一次修订,广受业界人士关注,本文对新旧版《国家药品标准物质管理办法》主要新增修订内容进行了对比分析。
一、药品标准管理相关定义
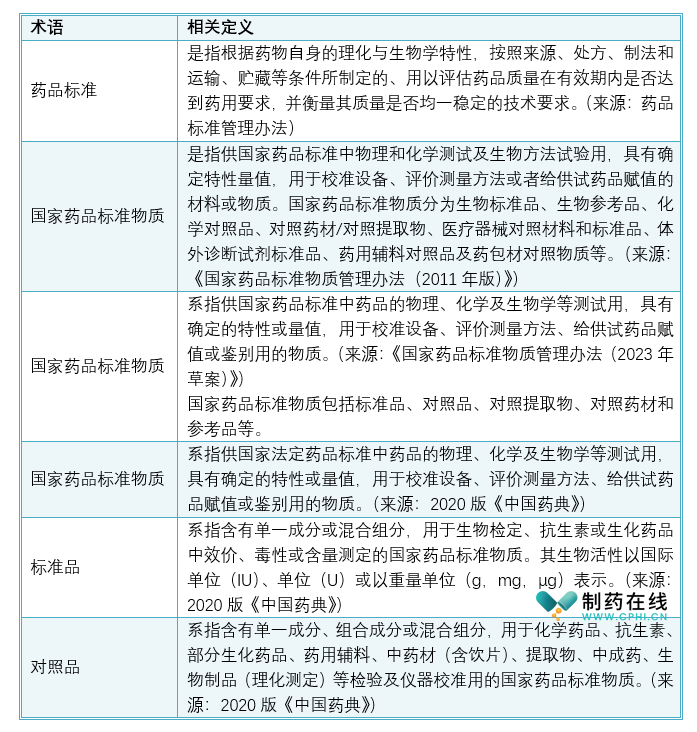
药品标准管理涉及众多专业名词,容易使人混淆。深入学习并掌握这些专业术语,是提升个人知识水平的基础环节。正确运用术语,不仅可以确保各方理解的一致性,减少沟通障碍,还能有效避免在实际操作中产生误解或误用。为了更好地进行药品标准管理,我们有必要对这些相关定义进行梳理和明确。为统一标准物质概念和分类管理,《国家药品标准物质管理办法(2023年草案)》采用了《中国药典》四部中规定的国家药品标准物质的定义。较2011版办法更准确清晰。同时,对国家药品标准物质的具体分类进行了说明。
二、国内外监管机构对药品标准物质的性质管理要求对照表
国家药品标准物质是确保药品质量和安全的关键要素,其在药品检验中的地位不容忽视。通过不断完善和优化国家药品标准物质的研制、标定和使用规范,我们能够更好地保障公众用药的安全性和有效性,推动我国药品产业的健康发展。通过与世界卫生组织(WHO)或其他国际一级标准物质的链接,国家药品标准物质实现了量值的国际传递和认可。这不仅增强了我国药品标准在国际上的认可度,也为国内药品生产企业和监管机构提供了可靠的溯源途径,满足了他们对所用国家药品标准物质的溯源性需求。

三、明确药品标准物质各相关方职责
《国家药品标准物质管理办法(2023年草案)》明确规定了中检院、省级药品监督管理部门、国家药品标准物质技术委员会和秘书处、国家药典委员会和药审中心、全国企事业单位等各方在药品标准物质研制管理中的地位和职责。

参考文献
[1]NMPA、中检院等网站



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57