临床试验数据在药物研发过程中具有无可替代的重要性,它不仅是整个临床试验的核心,更是评估药物安全性和有效性的基石。这些数据经过统计分析,能够为药物的进一步研发和使用提供关键的决策依据。确保临床试验数据的准确性和完整性对于药物研发的进程和结果至关重要。2024年1月11日,中国医药质量管理协会官网发布了由中国医药质量管理协会组织起草的《临床试验数据管理质量核查要点》(T/CQAP3013-2023)团体标准,2024年1月10日起实施,该团体标准在制定过程中,以GCP为准绳充分考虑了临床试验数据管理的实际情况,注重科学性和实用性。将为医药行业的临床试验数据管理提供更加明确和具体的指导,为临床试验数据管理核查提供参考依据,标准也必将在实践中得到不断的完善和改进,推动行业的发展和进步。
一、临床试验数据管理质量核查缺陷如何分类?
参照国家药品监督管理局(NMPA)《药品注册核查要点与判定原则(药物临床试验)(试行)》、国家药品监督管理局药品审核查验中心(CFDI)检查一处药品注册临床试验现场核查缺陷分级和结果判定程序,对临床试验数据管理质量核查发现问题分为严重缺陷、主要缺陷、一般缺陷。

二、临床试验数据管理质量核查内容和要点
临床试验数据管理是药物研发过程中最重要、最有价值的产出之一,是整个临床试验过程中的核心,最终作为统计分析的基础用以论证药物的安全性及有效性,作为医药质量管理领域的一项重要标准,T/CQAP3013-2023《临床试验数据管理质量核查要点》团体标准旨在促进临床试验数据管理的规范发展,提高数据管理质量,确保临床试验结果的准确性和可靠性。
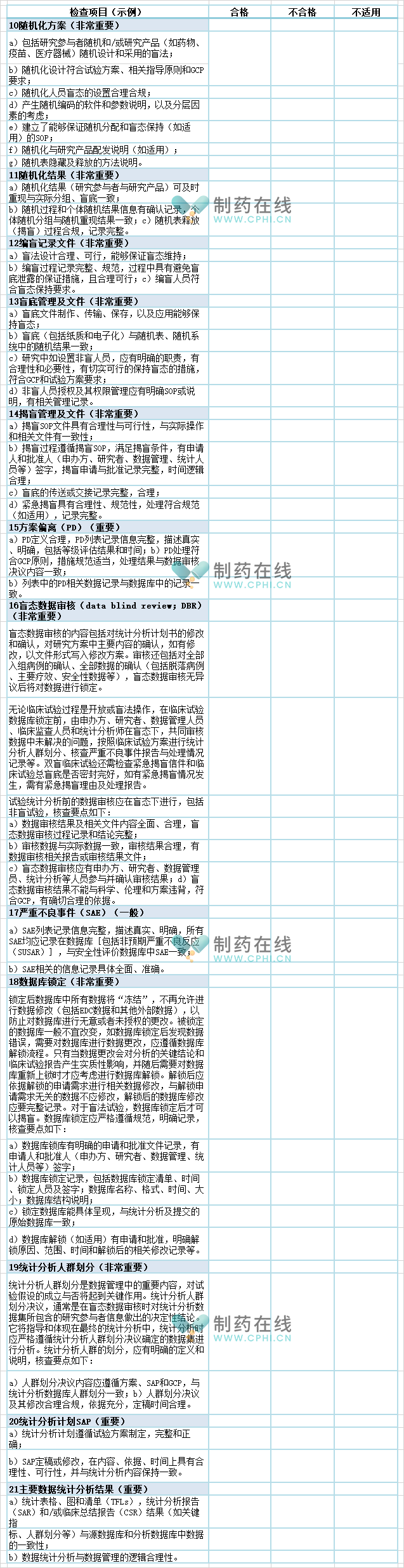
团体标准《临床试验数据管理质量核查要点》中随机化方案、随机化结果、编盲记录文件、盲底管理及文件、揭盲管理及文件、方案偏离、盲态数据审核、严重不良事件、数据库锁定、统计分析人群划分、统计分析计划、主要数据统计分析结果等临床相关要素的质量核查内容和要点的示例如下表:
相关阅读:《收藏了!新政下专家教你如何开展临床试验数据管理质量核查?(上) 》
参考文献
[1] 中国医药质量管理协会官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57