急性淋巴细胞白血病(ALL)是一种早期分化受阻的淋巴细胞恶性增殖性疾病,可侵犯骨髓、外周血及髓外组织,以B淋巴细胞白血病(B-ALL)为主。B-ALL在儿童急性白血病中的发病率约为80%,在成人急性白血病的发病率为20%。
随着医学技术的进步,B-ALL的治疗已取得可喜进展,尤其是儿童B-ALL。不过一线治疗后,近50%的成人B-ALL患者和高达20%的儿童B-ALL患者最终会复发或原发耐药。B-ALL患者一旦出现复发或难治(R/R),患者长期生存结局堪忧,中位生存期仅3.3个月。
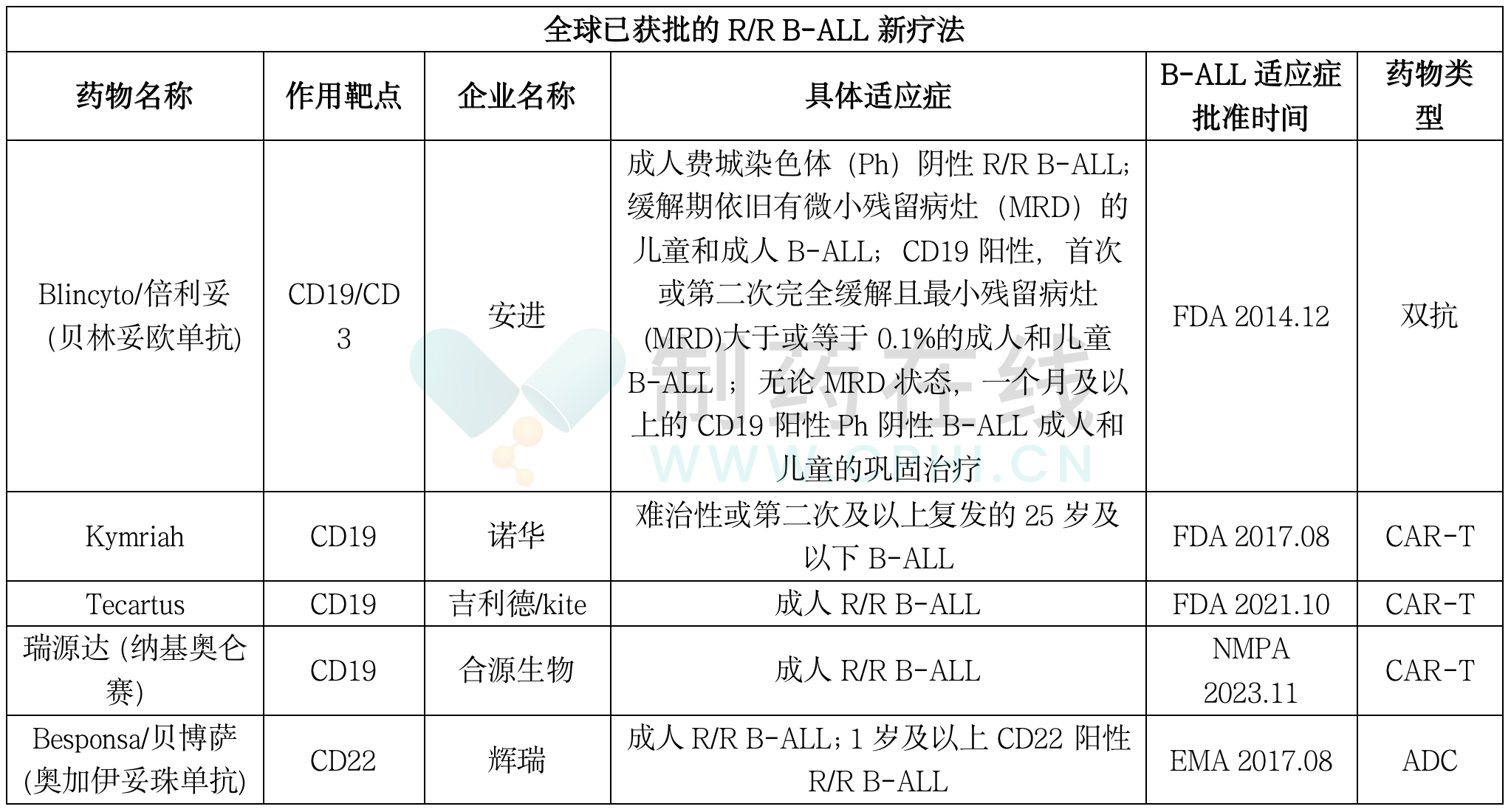
近年批准的R/R B-ALL新疗法
据不完全统计,近年来全球监管机构已批准多款R/R B-ALL药物,详见下表。这几款药物作用靶点比较集中,主要为CD19。药物类型上,这几款药物以CAR-T疗法为主,不过涉及的药物类型均是医药领域的热门赛道。具体适应症上,这几款药物几乎均被批准用于治疗成人R/R B-ALL。
在研R/R B-ALL疗法进展
目前,全球还有多款在研R/R B-ALL新疗法,其中obecabtagene autoleucel (obe-cel)、pCAR-19B(普基仑赛)进展较快,目前已申请上市。其中Obe-cel是Autolus Therapeutics开发的一种CD19靶向自体CAR-T疗法,其设计的嵌合抗原受体在与CD19结合后具有较快的解离速度,从而能够尽量减少T细胞的过度激活,在降低毒副作用的同时,不易发生T细胞耗竭,提高CAR-T疗法的持久性。
2024 ASCO上公布的Obe-cel治疗R/R B-ALL的开放标签、单臂1b/2期临床试验FELIX数据显示:截至2023年9月13日,共127名患者接受了Obe-cel输注,中位随访16.6个月,78%的患者达到完全缓解或不完全计数恢复的完全缓解。缓解患者中,17%(17/99)在缓解期间进行了巩固性造血干细胞移植(SCT),所有17名患者均处于可测量残留病灶(MRD)阴性缓解状态,其中59%(10/17)在SCT前显示出CAR-T细胞持续性。与持续CAR-T细胞患者相比,失去CAR-T细胞持续性复发或死亡的风险增加2.9倍。与未恢复B细胞的患者相比,经历B细胞恢复的患者复发或死亡的风险增加1.7倍。12个月时,无论是否考虑巩固性SCT或新疗法的审查,EFS(无时间生存期)率分别为50%和43%;无论是否考虑SCT的审查,OS率分别为61%和59%。
目前,Obe-cel治疗R/R B-ALL的BLA正在美国接受审查,预计今年11月将收到FDA回复。
pCAR-19B是精准生物自主研发的一款CD19靶向CAR-T疗法,其采用更为安全的基因转导载体系统,从而具有更好的有效性和安全性。 2023年11月,pCAR-19B被CDE纳入突破性治疗品种,用于治疗3~21岁CD19阳性R/R B-ALL。
已公布的pCAR-19B针对儿童和青少年B-ALL的注册临床试验结果显示:入组的9例患者均获得完全缓解(CR),总体缓解率达100%,且首次达到CR的患者MRD也均为阴性;无剂量限制性毒性(DLT)和治疗相关死亡事件发生,总体安全性和耐受性良好。
2024年6月,pCAR-19B被CDE拟纳入优先审评,用于治疗3~21岁CD19阳性R/R B-ALL。
此外,AZD0486、CN201、UCART22、GC007g、GC012F等也被开发用于治疗R/R B-ALL。其中AZD0486是TeneoTwo研发的一款新型全人源CD19 x CD3 IgG4双特异性抗体,阿斯利康通过收购TeneoTwo将其纳入囊中。AZD0486含有独特的低亲和力抗CD3片段,旨在减少细胞因子释放,同时保留T细胞介导的对恶性B细胞的有效细胞毒性。沉默的Fc段可防止非特异性结合及抗体依赖性细胞毒性,并具有适合间歇性给药的长半衰期。
临床前研究显示,AZD0486通过与CD19(B细胞上表达的抗原)和T细胞上的CD3受体结合,激活T细胞并将其募集到表达CD19的肿瘤中,引发免疫反应。2024年3月,AZD0486在国内获批临床,用于治疗R/R B-ALL。
CN201是同润生物开发的一款CD19/CD3靶向双抗,其在结构上进行了一定的优化,增加了Fc段,并改良了CD3端的结构,以调节CD3端的亲和力减低细胞因子释放综合征。
2024 ASCO上公布的CN201治疗成人R/R B-ALL的1期临床试验数据显示:截至2024年1月31日,共42名成人患者接受了从600mg至40mg的全剂量CN201治疗。在37名可评估疗效的患者中,尚未达到最大耐受剂量。6名患者(14.3%)发生了3级或更高级别的感染。疗效上,37名患者中有11名(30%)实现了CR,1名(2.7%)患者实现了不完全血液学恢复的完全缓解(CRi),75%的有反应者达到了MRD阴性。随着剂量的降低,CR率显著增加,10mg目标剂量时CR率达到50%,其中两名在CN201治疗后的前两周内发生。这些有反应的患者中,100%为MRD阴性。高剂量水平患者的CR率仍在调查中。
UCART22是基于基因编辑技术TALEN和Cellectis开创性的电穿孔系统PulseAgile开发的同种异体基因编辑CAR-T疗法,靶向CD22,被开发用于治疗成人R/R B-ALL。 据公司官方称,UCART22是目前开发用于治疗R/R B-ALL的疗法中最先进的同种异体CAR-T疗法。
GC007g和GC012F均由亘喜生物研发,其中GC007g是一款靶向CD19的供者来源异基因CAR-T细胞疗法,GC012F是一款CD19/BCMA双靶点自体FasTCAR-T疗法,其使用开创性的FasTCAR次日生产技术,相对于传统技术生产的CAR-T,具有更年轻的CAR-T细胞表型,并在临床前动物模型研究中,展现出强劲的肿瘤杀伤能力。
总结
新疗法的涌现改变了很多疾病的治疗格局,R/R B-ALL也不例外。CAR-T、双抗、ADC等热门疗法目前已闯进了R/R B-ALL治疗领域,尤其是CAR-T疗法。《中国临床肿瘤学会(CSCO)恶性血液病诊疗指南2024》已将CAR-T疗法均由II级推荐提升至I级推荐,用于Ph阳性R/R B-ALL。值得骄傲的是,我国药企在R/R B-ALL领域也有斩获,合源生物的纳基奥仑赛已率先出线,精准生物的pCAR-19B已被CDE纳入优先审评。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57