贝伐珠单抗是研发热度最高的生物类似药之一,2024年9月23日,国家药典委员会正式发布了《贝伐珠单抗注射液国家药品标准草案公示》,此举旨在提升标准的科学性、合理性及实用性,同时积极与国际顶尖标准接轨。作为生物科技领域的"抗癌大将",贝伐珠单抗注射液是首个获得临床批准的抗肿瘤血管生成药物。其成功问世,不仅标志着肿瘤靶向治疗新时代的开启,也为后续药物研发树立了里程碑式的典范。本文对贝伐珠单抗注射液质量标准主要内容及国内上市审批情况进行了分析。
一、贝伐珠单抗作用机制
贝伐珠单抗是一种用于治疗多种癌症的药物,其主要作用机制是通过特异性地结合血管 内皮生长因子(VEGF)并阻断其与VEGF受体(VEGFR)的结合,从而抑制肿瘤新生血管的形成。这种作用机制有助于减少肿瘤的血流和体积,阻止肿瘤细胞的生长和扩散。具体来说,贝伐珠单抗的作用机制包括:
● 抑制新生血管生成:通过阻断VEGF与其受体的结合,减少肿瘤的血管形成,从而抑制肿瘤细胞的生长。
● 使现有肿瘤血管正常化:帮助已有的肿瘤血管变得更加健康和稳定。
● 抑制上皮-间质转化(EMT)和肿瘤干细胞的增殖:这有助于减缓肿瘤的生长和扩散。
二、我国贝伐珠单抗商业化生产批准情况
贝伐珠单抗(Bevacizumab)是由美国安进公司研发生产的生物类似药,其原研药bevacizumab于2017年9月和11月分别获得美国和欧盟的批准。贝伐珠单抗是一种靶向血管 内皮生长因子(VEGF)的人源化单克隆抗体,通过特异性结合VEGF,阻断其与血管内皮细胞表面的VEGF受体结合,从而抑制肿瘤血管生成,发挥抗肿瘤作用。
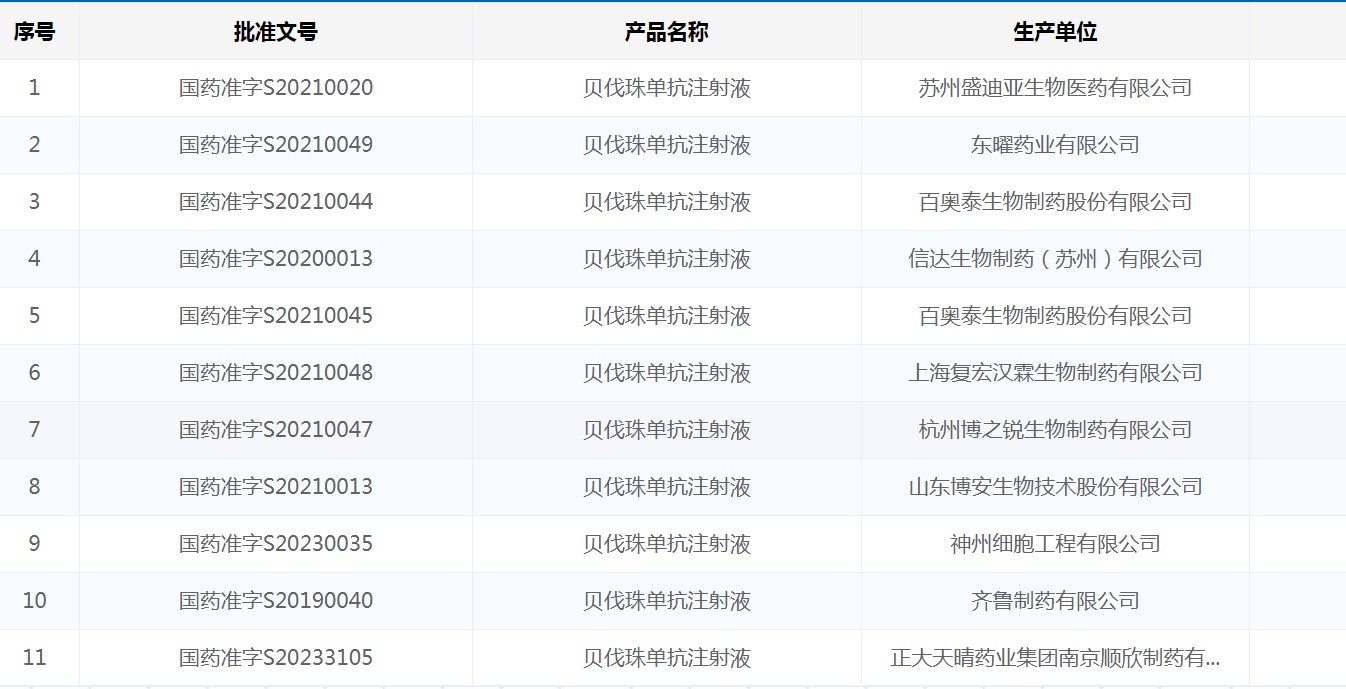
截至2024年9月底,国内已有10家企业生产的贝伐珠单抗注射液获批上市,包括复宏汉霖、信达生物、正大天晴等。其中,百奥泰有两个规格的产品获批。这些产品的上市为患者提供了更多的治疗选择,同时也促进了市场竞争。
国家药品监督管理局批准上市的贝伐珠单抗药品(截至2024年9月底)
三、贝伐珠单抗注射液的质量标准
贝伐珠单抗注射液是由含有高效表达贝伐珠单抗基因的中国仓鼠卵巢(CHO)细胞,经过细胞培养、分离和高度纯化以及病毒去除/灭活后获得的无菌溶液。贝伐珠单抗是一种人源化IgG1k单克隆抗体,分子量约为149kDa,由两条含有453个氨基酸残基的重链和两条含有214个氨基酸残基的轻链组成。重链和轻链之间以及重链之间通过二硫键连接,重链在303位的天冬氨酸上具有一个N端连接的糖基化位点。贝伐珠单抗包含人类IgG1k抗体的框架区以及可以结合人血管 内皮生长因子(VEGF)的人源化鼠抗体的抗原结合区。该注射液的质量标准涵盖多个检测项目,包括鉴别、pH值、澄清度、渗透压摩尔浓度、可见异物、不溶性微粒、装量、纯度与杂质、聚山梨酯80/20含量(如有)、细菌内毒素、无菌性、异常毒性、生物学活性和含量测定等。贝伐珠单抗注射液质量标准摘录如下表。
贝伐珠单抗注射液质量标准
|
检测项目 |
检测方法 |
质量标准 |
|
鉴别(1)肽图 |
肽图检查法(通则3405) |
供试品溶液图谱应与对照品溶液图谱一致。 |
|
鉴别(2)全柱成像毛细管等电聚焦电泳法 |
单抗电荷变异体测定法(通则3129)第一法 |
供试品溶液图谱应与对照品溶液一致,供试品溶液主峰和对照品主峰溶液的等电点差值不得大于0.2。 |
|
颜色 |
通则 0901溶液颜色检查法 |
应符合规定 |
|
澄清度 |
通则0902澄清度检查法 |
与3号浊度标准液比较,不得更浓。 |
|
pH |
通则0631pH值测定法 |
应符合规定 |
|
渗透压摩尔浓度 |
通则0632渗透压摩尔浓度测定法 |
应符合规定 |
|
装量 |
注射剂(通则0102) |
应符合规定 |
|
可见异物 |
通则0904可见异物检查法 |
应符合规定 |
|
不溶性微粒 |
通则0903不溶性微粒检查法 |
应符合规定 |
|
纯度与杂质(1)分子排阻色谱法 |
分子排阻色谱法(通则0514) |
供试品溶液2中贝伐珠单抗含量不得低于93%,供试品溶液1中聚体含量不得高于12%。 |
|
纯度与杂质(2)离子交换色谱法 |
高效液相色谱法(通则0512) |
贝伐珠单抗不得小于45.0%,酸性组分含量不得过42.0%,碱性组分含量不得过18.0%。 |
|
纯度与杂质(3)毛细管凝胶电泳法 |
单抗分子大小变异体测定法(通则3127)第一法 |
还原电泳限度贝伐珠单抗重链、非糖基化重链和轻链的修正峰面积不得小于总修正峰面积的94.0%。 |
|
非还原电泳限度贝伐珠单抗主峰修正峰面积不得小于总修正峰面积的90.0%,片段修正峰面积不得高于总修正峰面积的10.0%。 |
||
|
聚山梨酯80含量(如有) |
通则3203聚山梨酯80残留量测定法 |
应符合规定 |
|
聚山梨酯20含量(如有) |
高效液相色谱法(通则0512) |
应符合规定 |
|
异常毒性 |
通则1141小鼠试验法 |
应符合规定 |
|
无菌 |
通则1101薄膜过滤法 |
应符合规定 |
|
细菌内毒素 |
动态显色法(通则1143) |
每1ml不得大于2 EU。 |
|
生物学活性 |
通则3541贝伐珠单抗生物学活性测定法 |
供试品生物学活性应为标准品的70%~130%。 |
|
含量测定 |
紫外-可见分光光度法(通则0401) |
应为标示量的90%~110%。 |
参考文献
[1] www.cde.org.cn、www.chp.org.cn等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57