据报道,截止到2020年8月8日15时(北京时间),全球新冠肺炎累计感染人数超过1950万例,死亡人数也达到了72万之多,与此同时全球每日新增病例数已经连续多日维持在24万左右,全球新冠疫情形势仍处于加剧恶化的趋势当中,为规范我国新冠肺炎疫情期间的药物临床试验,提供有效的安全管理措施,在国家药品监督管理局的部署下,国家药品监督管理局药品审评中心官网发布了《新冠肺炎疫情期间药物临床试验管理指导原则(试行)》,自发布印发之日(2020年7月14日)起施行,这是国内首部针对新冠肺炎疫情期间药物临床试验指南,本文对《新冠肺炎疫情期间药物临床试验管理指导原则》起草背景及主要内容进行了解读分析。
一、起草背景及制定依据分析
目前,全球新冠肺炎疫情还在愈演愈烈,新冠肺炎疫情期间的药物临床试验面临诸多困难和挑战,为了帮助药物临床试验正常推进,促进被影响的药物临床试验及时补救,为保护受试者安全,落实临床试验申办者(以下简称申办者)主体责任,保证临床试验质量和数据真实、准确、完整和可追溯,国家药品监督管理局药品审评中心组织相关专家起草了《新冠肺炎疫情期间药物临床试验管理指导原则(试行)》,对疫情期间应急批准的新冠肺炎药物(包括**)临床试验和其他在研药物临床试验提出建议,供申办者和研究者参考。
欧盟EMA和美国FDA分别在3月和4月发布新冠疫情下控制临床试验通知,我国于2020年4月30日《新冠肺炎疫情期间药物临床试验管理指导原则》(征求意见稿),2020年7月14日正式落地,主要参考依据如下:
[1]国家药品监督管理局.国家药监局 国家卫生健康委关于发布药物临床试验机构管理规定的公告(2019年第101号)。 2020-11-29.
[2] 国家药品监督管理局.国家药监局 国家卫生健康委关于发布药物临床试验质量管理规范的公告(2020年第57号).2020-04-26.
[3] 国家药品监督管理局.《国家食品药品监督管理局药品特别审批程序》(局令第21号). 2005-11
[4] 国家市场监督管理总局.《药品注册管理办法》(国家市场监督管理总局令第27号). 2020-03-30.
[5] FDA. FDA Guidance on Conduct of Clinical Trials of Medical Products during COVID-19 Pandemic. 2020-4-16.
[6] EMA. Guidance on the Management of Clinical Trials during the COVID-19 (Coronavirus) pandemic.2020-3-27.
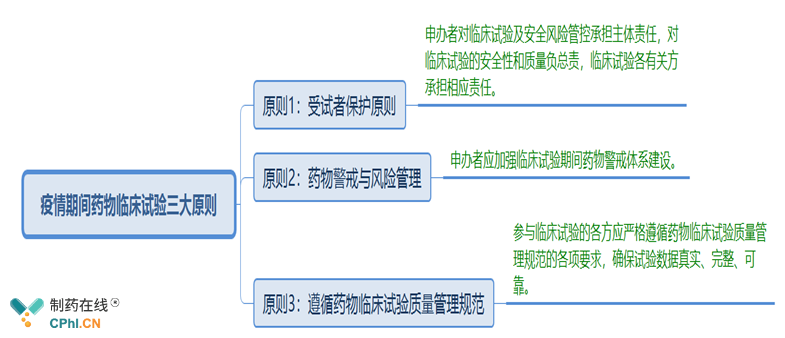
二、疫情期间药物临床试验三大原则
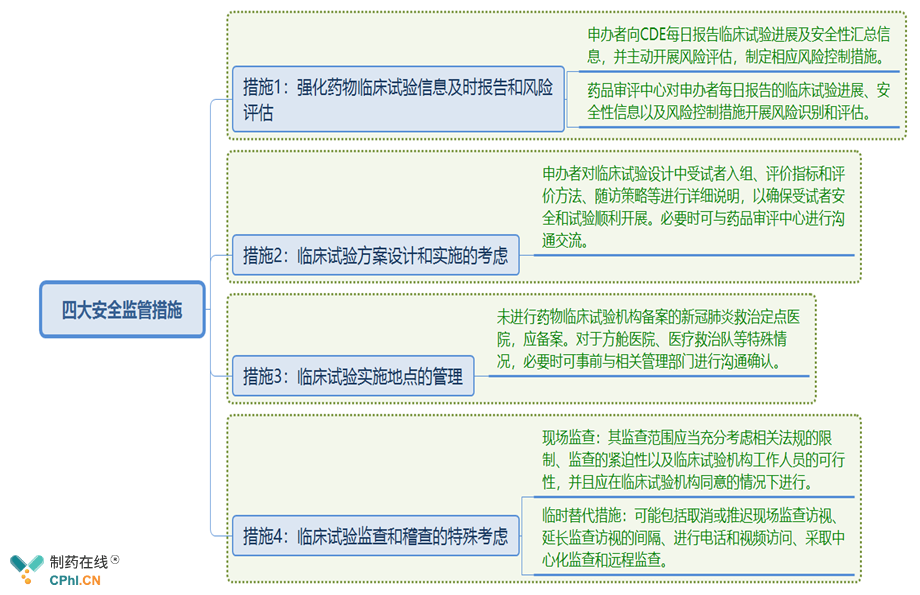
三、新冠肺炎治疗药物临床试验的四大安全监管措施
四、其它在研药物的临床试验的五大安全监管措施
受疫情影响,其它有些正在开展临床试验或者即将开展临床试验的新药研发进程可能受到很大影响。如果试验机构人员或受试者感染 COVID-19,将会面临可能来自隔离、试验机构关闭、受试药品发送等各方面的挑战,这些挑战会导致不可避免的试验方案偏差。从临床受试者招募到临床试验过程中的质量管理等均面临一些实际困难,针对这些关键问题,本指南为我国受疫情影响的其它药物临床试验的安全管理提供参考,主要概况为以下五大安全监管措施:
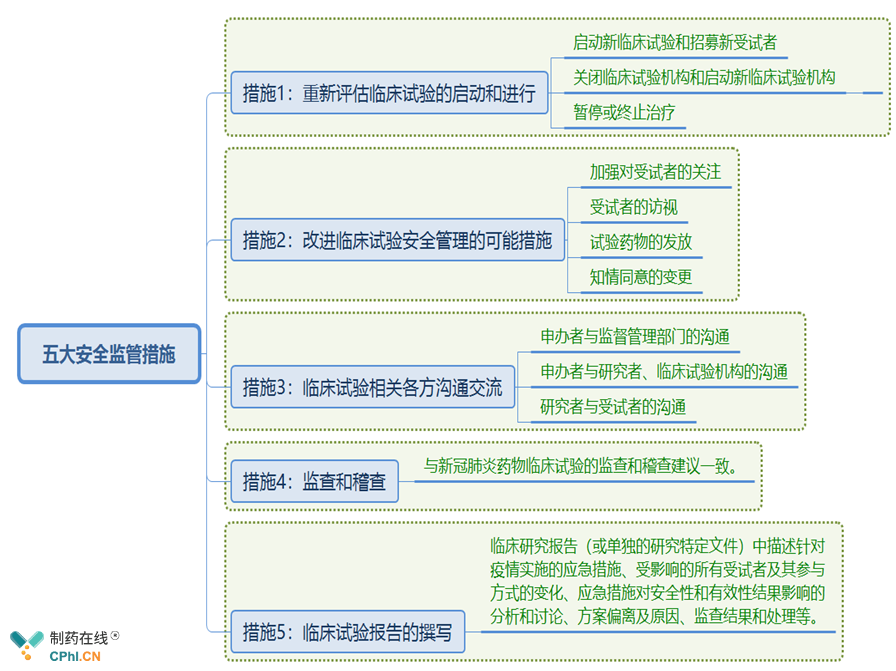
受疫情影响,其它有些正在开展临床试验或者即将开展临床试验的新药研发进程可能受到哪些方面的影响?CDE提供的主要应对措施有哪些?
1、重新评估临床试验的启动和进行 ?
1.1 启动新临床试验和招募新受试者 ?
需重点关注对受试者安全的影响,综合考虑试验药物的特点、临床试验各相关方安全监测的能力、疫情对试验药物供应链的潜在影响、所涉及疾病的性质以及临床试验机构所在地区采取的疫情防控措施等。
1.2 关闭临床试验机构和启动新临床试验机构 ?
1.2.1 如果必须关闭试验机构,则应在征得受试者同意的情况下,将受试者转移到可开展试验的临床试验机构,例如远离风险区或离家较近的试验机构、已经开展试验的试验机构或者可能产生的新试验机构。
1.2.2 如果需要紧急启动新临床试验机构进行关键性试验访视,可以先作为紧急安全措施实施,在药品审评中心药物临床试验登记与信息公示平台进行信息更新并提交公示。若涉及重大方案变更,应提交补充申请。
1.3 暂停或终止治疗 ?
申办者应与研究者协商,决定是否暂停或者终止治疗,并及时报告伦理委员会,以确保受试者安全。
2、改进临床试验安全管理的可能措施 ?
2.1 加强对受试者的关注 ?
可通过电话、微信等多种途径密切了解受试者健康状况,确认受试者是否有疫情高发区域居住史或旅行史、是否有确诊或疑似感染人群接触史、发热门诊就诊史等,一旦出现安全性问题应及时处理。
2.2 受试者的访视 ?
若申办者或者临床试验机构有对受试者进行COVID-19筛查的要求,除非申办者将收集的数据作为新的研究目标,否则即使在临床研究访视期间进行,也无需作为方案变更进行报告,但应做好相关记录。
2.3 试验药物的发放 ?
对于试验药物发放的变更,首要目标是根据试验方案给受试者提供试验药物,以确保受试者安全和临床试验完整性。对于通常可以自行使用的试验药物,可调整成替代的安全运送方法。可在受试者家中交付不会增加任何新的安全风险的试验药物,从而避免受试者往返临床试验现场取药。
2.4 知情同意的变更 ?
可考虑用替代手段获得重新知情同意。例如通过邮件或者快递、电子邮件等方式将最新患者信息表和知情同意书提供给受试者。通过电话或者视频电话与受试者联系,获得口头同意并附上电子邮件等形式的确认。对于以此种方式获得的知情同意应记录在案,当受试者可以返回临床试验机构时,应该尽早通过常规知情同意程序进行确认。
3、临床试验相关各方沟通交流 ?
3.1 申办者与监督管理部门的沟通 ?
申办者可就疫情防控措施对临床试验计划的影响和后果、方案变更对临床试验数据解读的影响、方案变更将导致数据管理和/或统计分析计划的修改等问题与监督管理部门进行沟通讨论。
3.2 申办者与研究者、临床试验机构的沟通 ?
申办者应就试验实施的相关变更,与研究者、临床试验机构进行商定。
3.3 研究者与受试者的沟通 ?
任何情况下,让受试者及时了解可能影响他们的研究和监测计划的变化至关重要。
参考文献
[1] www.cde.org.cn/news.do?method=viewInfoCommon&id=52016e68a65b6161
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57