2021年12月1日起实施的《药物警戒质量管理规范》,将第七章第二节“药物警戒体系主文件”单独列为一节,彰显药物警戒体系主文件的重要性。为贯彻落实《药物警戒质量管理规范》颁布实施,指导MAH创建和维护药物警戒体系主文件,2022年2月25日,国家药品不良反应监测中心官网发布了《药物警戒体系主文件撰写指南》,作为药物警戒相关人员,结合公司自身情况和工作需要,如何撰写满足监管的药物警戒系统主文件是当前药品上市许可持有人(MAH)最迫切关心的系列问题之一。笔者梳理了药物警戒体系主文件实践方面一些关注点,以期对大家下一步主文件工作推动有所帮助。
一、什么是药物警戒系统主文件
药物警戒体系主文件(英文名:Pharmacovigilance System Master File,简称 PSMF),目前在国内相关法规未见到具体的定义,在2021年12月1日起实施的《药物警戒质量管理规范》有规定,持有人应当创建并维护药物警戒体系主文件,用以描述药物警戒体系及活动情况。而欧盟EMA药物警戒体系主文件是指对上市许可持有人一种或多种药品的药物警戒体系的描述。(依据:EMA Directive 2001/83/EC 关于欧洲共同体内人用医用产品规范的指令)
二、药物警戒体系主文件相关政策要求
(1)2021年5月13日,国家药监局发布《药物警戒质量管理规范(简称“GVP规范”)》(2021年第65号)(2021年12月1日起实施)第七章第二节将“药物警戒体系主文件”单独列为一节,要求药品上市许可持有人创建并维护药物警戒体系主文件,笔者梳理了一下GVP规范,涉及药物警戒体系主文件共用5条款,内容概述如下表:

(2)2022年2月25日,国家药品不良反应监测中心官网发布了《药物警戒体系主文件撰写指南》,提出了撰写药物警戒体系主文件的一般要求。持有人应当结合自身实际情况,撰写反映药物警戒活动情况的药物警戒体系主文件。
三、MAH如何创建和维护合规的药物警戒体系主文件?
药物警戒体系主文件是对持有人的药物警戒体系及活动情况的描述,应当与现行药物警戒体系及活动情况保持一致,并持续满足相关法律法规和实际工作需要,通过创建和维护药物警戒体系主文件,持有人应当确保药物警戒体系的合规性、保证药物警戒体系按照要求运行、能够及时发现药物警戒体系存在的缺陷与其他风险信息,保障药物警戒活动的有序开展以及对药物警戒体系的持续改善,笔者建议药品上市许可持有人MAH应尽快安排对照新落地实施的《药物警戒体系主文件撰写指南》一般要求进行差距分析,持有人应当结合自身实际情况,撰写反映药物警戒活动情况的药物警戒体系主文件,MAH药物警戒系统主文件内容建议至少包括以下几个方面:

四、MAH如何对药物警戒体系主文件进行差距分析?
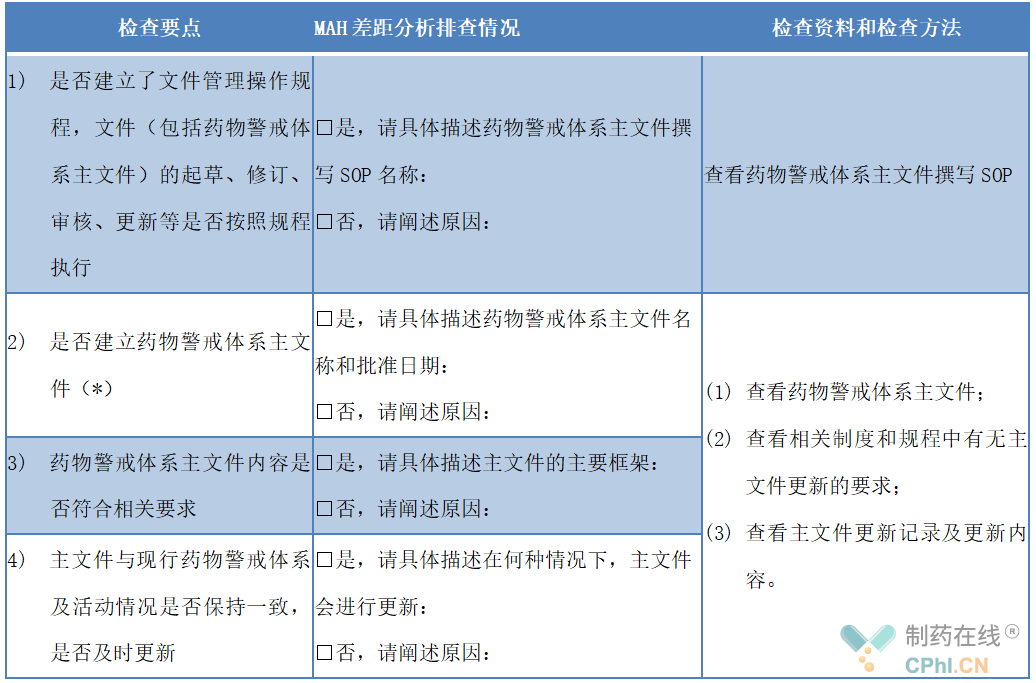
笔者参考国家药监局2021年12月发布的《药物警戒检查指导原则(征求意见稿)》,梳理了药物警戒体系主文件相关自查条款,以期对大家下一步主文件工作推动有所帮助。
[1]www.cdr-adr.org.cn及培训课件



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57