EDQM作为一个国际知名的药政机构,除了出版欧洲药典和器官移植的各类政策,还对拟进入欧盟市场的原料药进行评估。为了对原料药供应商的产品进行评价,EDQM推出了CEP认证项目;这个项目过去被称为COS认证。随着CEP认证程序的成熟,认证范围被扩大,从API扩展到非活性物质。因此,到目前为止,CEP认证项目包含API和辅料这2大类物质。
EDQM在审评物质生产商递交的申报资料后,发现很多共性缺陷,因此会定期发布CEP申报资料十大缺陷,向申请人提供有价值的信息。但是在2023年之前的几个年度,未发布类似信息。在2024年春节期间,EDQM再次发布《TOP TEN DEFICIENCIES in New Applications for Certificates of Suitability for chemical purity》,再次向各国API和辅料制造商释放指导信号。笔者将汇总这些信息,相应的解读,希望对于中国API公司和辅料公司提供有价值的借鉴信息。
第一部分:CEP认证2.0版的影响
◆CEP2.0发展历程
---2020年,EDQM发起这个项目;只是当时处于疫情期间,行业关注度不高。
---2022年1月,CEP2.0项目征集意见结束。
---2022年10月,分为三个小组来讨论。
---202303,EDQM发布实施文件。
---20230601,CEP2.0项目正式开始实施。
◆CEP2.0项目主要影响领域
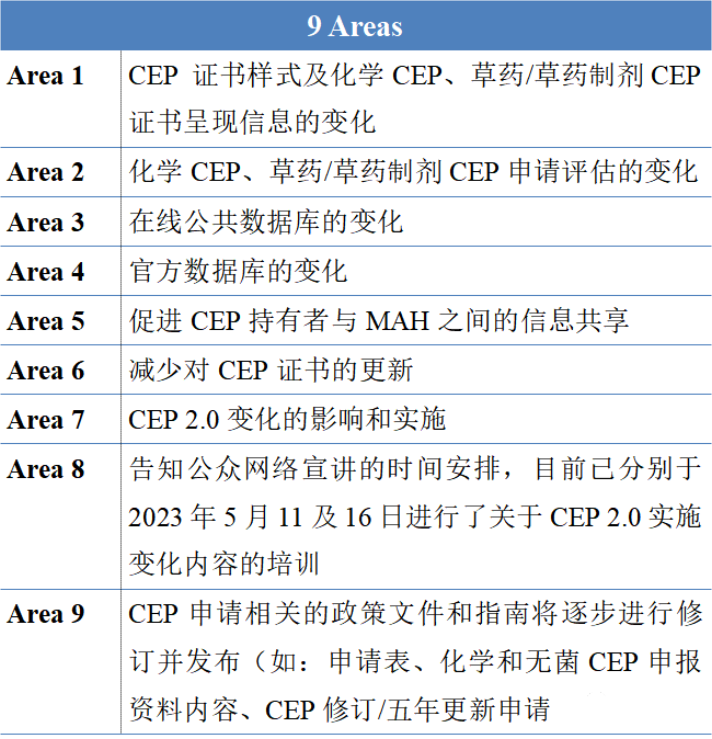
◆需要提醒中国制药行业关注的领域
在上面表格列出的影响领域里面,可以看到第四个领域是官方数据库的变化。根据官网信息,EDQM已于2023年6月19日公布了可以分享技术信息国家清单,包括巴西、加拿大、新加坡、以色列、韩国、日本、PIC/S(瑞士)、沙特阿拉伯、南非、中国台北、澳大利亚、美国、WHO(瑞士)等。这就意味着,当中国企业向EDQM递交技术资料后,如果再向这些国家递交资料,需要保持一致性。
第二部分:过去CEP申报资料典型缺陷分布情况
下面表格根据EDQM发布的历年十大缺陷信息来整理汇总:
|
缺陷排名 |
2009年度 |
2011年度 |
2016年度 |
2023年度 |
|
排名01缺陷 |
3.2.S.2.2/ 3.2.S.2.3 |
3.2.S.2.3 |
S.3.2 |
3.2.S.2.2 |
|
排名02缺陷 |
3.2.S.2.3 |
3.2.S.2.2/ |
S.2.3 |
3.2.S.2.4 |
|
排名03缺陷 |
3.2.S.2.3 |
|
S.2.2, S.2.4 |
3.2.S.3.2 |
|
排名04缺陷 |
3.2.S.3.2 |
3.2.S.4.4 |
S.2.3 |
3.2.S.2.3 |
|
排名05缺陷 |
3.2.S.4.4 |
3.2.S.2.3 |
S.2.3 |
3.2.S.2.3 |
|
排名06缺陷 |
3.2.S.2.3 |
3.2.S.2.3 |
S.2.3 |
3.2.S.2.2 |
|
排名07缺陷 |
3.2.S.4.3 |
3.2.S.2.3 |
S.3.2 |
3.2.S.3.2 |
|
排名08缺陷 |
3.2.S.6 |
3.2.S.2.4 |
S.2.4 |
3.2.S.3.2 |
|
排名09缺陷 |
3.2.S.3.2 |
3.2.S.4.3 |
S.3.2 |
3.2.S.3.2 |
|
排名10缺陷 |
3.2.S.2.3 |
3.2.S.4.3/ 3.2.S.2.2 |
S.2.3 |
3.2.S.2.3 |
说明和分析:
---上面表格中的信息,指的是这个技术缺陷和CTD申报资料对应的章节编号。
---从上面内容可以看出,针对申请人提交的申报资料,缺陷主要集中于SM选择和杂质控制。
第三部分:2023年度CEP申报资料典型缺陷解析
在2024年春节期间,EDQM再次发布《TOP TEN DEFICIENCIES in New Applications for Certificates of Suitability for chemical purity》。下面介绍这份最新的技术文件,以便中国医药企业理解欧盟对API的最新管理要求。
◆TOP 1: 3.2.S.2.2
缺乏详细信息和/或对起始物料引入后的物质制造工艺描述不足(包括第S.2.3节和第S.2.4节中给出的信息之间的差异)。(占所有问题的12%)
具体来说:
---对于合成工艺和半合成工艺生产的物质,希望申请人提供合成工艺流程图。所有合成中间体都应列出,如果属于非分离中间体,则应放在工艺流程图的方括号内。
---在EDQM专家审核合成工艺路线时,评估员会检查CTD申报资料的S.2.2部分、S.2.3部分和S.2.4部分中的信息是否一致。申请人应确保所有使用的原材料(包括回收的材料)均在CTD的第S.2.2部分和 S.2.3部分进行介绍,并且没有错误地包含任何试剂。
---在制造工艺的每个阶段,应详细说明所有原材料的使用数量和批量大小。
---如果进行中间体或最终物质的混合,工艺描述应明确说明它是按照 ICH Q7 进行的,并且在混合之前对批次进行了全面质量项目的测试。
◆TOP 2: 3.2.S.2.4 and TOP 4: 3.2.S.2.3
为控制分离的中间体(占所有问题的11%)和起始物料(占全部问题的7%)的质量而提出的质量标准不充分或论证不合理。
具体来说:
---希望起始物料和分离中间体的质量标准包括对特定杂质、非特定杂质和总杂质的适当验收标准。验收标准应根据杂质最后形式和杂质的传递途径来证明其合理性(这有时可能需要加标研究)。应讨论杂质对最终物质质量的任何潜在风险。
---EDQM评估人员期望任何主要和反复出现的杂质满足下面要求;
a)这些杂质将被鉴别和/或表征。
b)将根据杂质最终形式和杂质传递途径讨论来论证合理验收标准。
如果建议的非特定杂质验收标准比针对特定杂质的建议的验收标准更宽,这应该是有充分理由的。
应解决质量平衡(含量和总杂质测试结果的总和)的差异。如果存在差异,则应加以解释。
◆TOP 3: 3.2.S.3.2
对最终物质中存在潜在致突变杂质的风险评估缺乏或缺乏讨论。(占所有问题的7.5%)
具体来说:
---CEP申请人应根据他们对该物质制造工艺的理解,在其申报资料中提供有关潜在致突变杂质的具体讨论。这应该包括那些:
a) 在制造工艺中引入的可能性(例如试剂、起始材料等);
b) 在最终物质合成工艺中生成的;
c) 来自降解产物的情况。
---此类杂质应根据 ICH M7 在申报资料中列出和分类(1 类至 5 类)。对于致突变杂质,应根据ICH M7原则提出合适的控制策略。
---杂质的毒理学关注阈值 (TTC) 应根据ICH M7确定。对于TTC的计算,原料药的最大日剂量 (MDD) 应基于欧盟公开评估报告 (EPAR)、产品特性摘要 (SmPC) 或公认的文献,例如马丁代尔,而适当的可接受摄入量应基于ICH M7中描述的适当使用持续时间。
---ICH M7指南的选项3对致突变杂质的控制应通过适当的加标和/或残留研究来证明其合理性。
---ICH M7指南的选项4控制措施应通过证明来支持,即基于对生产工艺的理解和对残留杂质水平的影响(包括杂质最终形式和清除知识),原料药中的杂质水平将始终低于可接受的限度。选型4的控制可能还需要得到分析数据的支持(例如加标和/或杂质携带数量研究)。
◆TOP 5: 3.2.S.2.3
从引入起始物料开始,最终物质制造过程中使用的原材料(包括回收的物料)的验收标准(和/或分析方法)缺乏或不充分。(占所有问题的7.1%)
具体来说:
---申请人应确保为最终物质制造工艺中使用的所有原材料提供合适的质量标准。
---在制造工艺后期使用的原材料标准不应包含宽松的标准,除非提供任何适当的理由。应解决使用这些材料(包括回收的材料)对最终物质杂质分布的影响。
---如果在制造工艺中使用鱼源性材料或蛋白胨,则应满足EDQM要求。
◆TOP 6: 3.2.S.2.2
原材料的返工和回收没有得到充分处理。(占所有问题的6.1%)
具体来说:
---返工:根据欧盟《Guideline on the Chemistry of Active Substances》指南,在CEP申报资料的第3.2.S.2.2部分,CEP 申请人应提供任何返工工艺步骤的详细叙述性描述,并定义返工工艺的触发因素。诸如"返工是批准的步骤 X 的重复"之类的陈述不被视为适当的替代。
---回收:在CTD文件第 3.2.S.2.2部分,CEP 申请人应适当地确定制造工艺中材料回收的点,详细描述如何回收材料,并清楚地确定它们在生产工艺中重新引入的位置。
◆TOP 7: 3.2.S.3.2
与亚硝胺杂质相关的风险评估缺少或不足。(占所有问题的4%)
具体来说:
新的 CEP 申请(化学、半合成、发酵产品或草药产品)预计将包括 ICH Q9 和 ICH M7 指南中概述的原则,以及当前 EMA 关于亚硝胺的问答文件(包括其附录 1)中概述的亚硝胺存在的全面风险评估。风险评估不仅应解决制造工艺中的风险,还应解决制造工艺中使用的材料(起始材料、试剂、新鲜溶剂和回收溶剂等)的引入以及降解物的风险。应适当处理与亚硝胺的形成和携带有关的任何风险,同时考虑上述EMA问答文件。
◆TOP 8: 3.2.S.3.2
未能充分说明有关物质的来源、去向和传递进入最终物质的情况。(占所有问题的4%)
具体来说:
---仅基于欧洲药典对杂质规定的讨论通常被认为是不够的,关于有关物质的讨论应涉及其他杂质(例如起始物料、中间体、与工艺相关的杂质和降解物)的形成、残留和归宿。
---应解决欧洲药典各论是否适用于控制药典各论透明性清单中不存在的杂质(即物质内部其他杂质),建议或要求对最终物质进行控制(例如发现高于报告限度的杂质)。
---在有关物质讨论的背景下,预计诸如"未检测到"或"低于定量限"之类的陈述将得到相关方法的LOD/LOQ的支持。
◆TOP 9: 3.2.S.3.2
关于残留溶剂的讨论不足。(占所有问题的4%)
具体来说:
---在讨论残留溶剂时,预计诸如"未检测到"或"低于定量限"之类的陈述将得到相关方法的LOD/LOQ的支持。
---应澄清作为制造工艺的副产品形成的杂质的来源,但这些杂质也是常见的溶剂(例如乙酸、乙醇)。
---在相关情况下,CEP申请人应讨论第1类溶剂(例如苯/四氯化碳/1,2-二氯乙烷/1,1-二氯乙烯/1,1,1-三氯乙烷)作为其他溶剂污染物的潜在存在,并证明符合ICH Q3C指南的附件1的要求。
◆TOP 10: 3.2.S.2.3
未能合理识别起始物料。(占所有问题的3.5%)
具体来说:
---应根据 ICH Q11指南和相关问答文件中概述的要求来确定和选择起始物料。建议的起始物料被认为是可接受的并符合适用指南的原因应在申报资料的第S.2.3部分中详细解释。
---将对最终物质有重要结构成分贡献的物质认定为试剂是不可接受的。根据 ICH Q11指南,此类物质应被确定为起始物料。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
相关阅读:
《龙年谈之二:2020-2023年中国企业欧盟认证情况梳理和趋势分析》




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57