
近期,国家药监局(NMPA)官网发布《药品上市许可持有人落实药品质量主体责任监督管理规定》,自2023年3月1日起实施,主要目的是督促药品上市许可持有人(文中简称MAH)落实药品质量主体责任,进一步加强药品全生命周期质量监督管理,进一步强化MAH主体责任,保障人民群众用药安全、有效。那么,MAH如何落实药品质量主体责任呢?
一、落实全过程质量安全监督重点
《药品上市许可持有人落实药品质量主体责任监督管理规定》中多次提到全过程安全监督,明确MAH应当依法对药品研制、生产、经营、使用全过程中药品的安全性、有效性、质量可控性负责,相关条款梳理如下:
1) 持有人应当遵守《中华人民共和国药品管理法》等相关法律法规,按照药品非临床研究质量管理规范、药品临床试验管理规范、药品生产质量管理规范、药品经营质量管理规范、药物警戒质量管理规范等要求,建立健全药品质量管理体系,依法对药品研制、生产、经营、使用全过程中药品的安全性、有效性、质量可控性负责(第三条)。
2) 持有人应当设立职责清晰的管理部门,配备与药品生产经营规模相适应的管理人员,明确非临床研究、临床试验、生产销售、上市后研究、不良反应监测及报告等职责,并符合相关质量管理规范的要求。持有人应当独立设置质量管理部门,履行全过程质量管理职责,参与所有与质量有关的活动,负责审核所有与质量管理有关的文件(第四条)。
3) 法定代表人、企业负责人(主要负责人)对药品质量全面负责。企业负责人全面负责企业日常管理,落实全过程质量管理主体责任(第六条)。
4) 持有人应当建立覆盖药品生产全过程的质量管理体系,按照国家药品标准、经药品监督管理部门核准的质量标准和生产工艺进行生产,确保药品生产全过程持续符合药品生产质量管理规范要求(第十一条)。
5) 持有人应当依法建立并实施药品追溯制度,按要求自建或者委托第三方建设信息化追溯系统,在药品各级销售包装单元赋予药品追溯标示,向下游药品经营企业、药品使用单位提供追溯信息,及时、准确记录并保存药品全过程信息,实现药品可追溯,并按照规定向药品监督管理部门提供追溯数据(第十八条)。
二、落实五个关键岗位责任
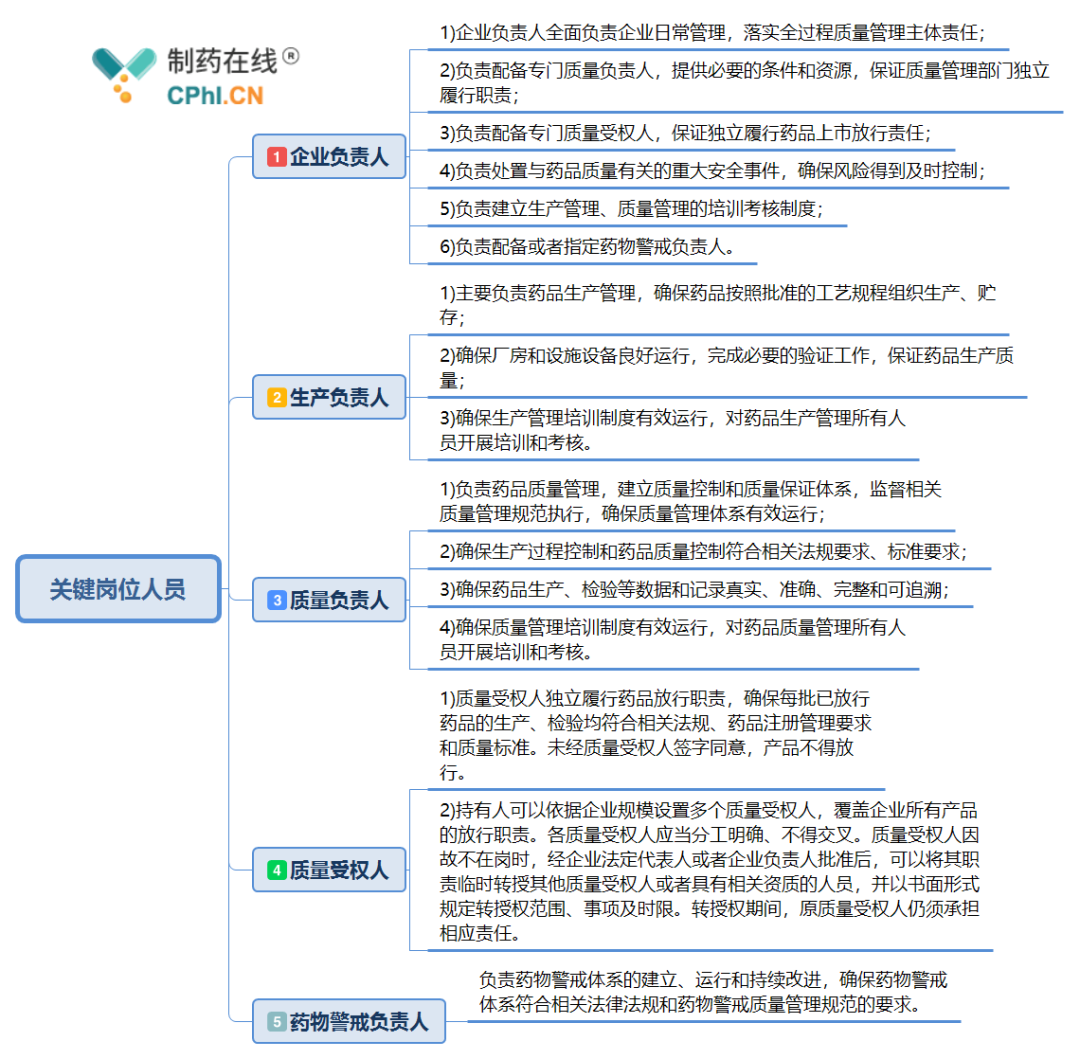
《药品上市许可持有人落实药品质量主体责任监督管理规定》明确落实MAH法律主体责任到5个关键岗位人员的重点要求,分别是“企业负责人、生产负责人、质量负责人、质量受权人、药物警戒负责人”5个关键岗位人员,关键岗位人员应当为企业全职人员,并符合相关质量管理规范有关要求。质量管理负责人和生产管理负责人不得互相兼任。那么新规对关键岗位人员岗位职责有哪些特殊要求?
三、落实9个质量管理制度
MAH需了解监管政策新动向,落实质量体系文件修订新要求,笔者梳理了以下几个管理制度需要自查,必要时,启动修改升级,如有遗漏欢迎大家留言补充,清单如下表:
制度1——培训管理制度
MAH英建立培训管理制度,制定培训方案或者计划,对从事药品研发管理、生产管理、质量管理、销售管理、药物警戒、上市后研究的所有人员开展上岗前培训和继续培训。培训内容至少包括相关法规、相应岗位职责和技能等。持有人应当保存培训记录,并定期评估培训效果。
另外需注意的是:生产负责人对药品生产管理所有人员开展培训和考核;质量负责人对药品质量管理所有人员开展培训和考核。研发管理、销售管理、药物警戒、上市后研究的部门负责人对本部门所有人员开展培训和考核。
制度2——药品追溯制度
MAH应当建立并实施药品追溯制度,按要求自建或者委托第三方建设信息化追溯系统,在药品各级销售包装单元赋予药品追溯标示,向下游药品经营企业、药品使用单位提供追溯信息,及时、准确记录并保存药品全过程信息,实现药品可追溯,并按照规定向药品监督管理部门提供追溯数据。
制度3——药品召回制度
MAH应当建立并完善药品召回制度,发现药品存在质量问题或者其他安全隐患的,按照有关规定启动召回,及时通知有关企业或者使用单位,同时将调查评估报告、召回计划和召回通知提交给所在地省级药品监督管理部门备案。召回的药品需要销毁的,应当按照有关规定进行销毁。
制度4——短缺药品停产报告制度
持有人应当建立短缺药品停产报告制度。列入国家实施停产报告的短缺药品清单的药品停止生产的,应当在计划停产实施六个月前向所在地省级药品监督管理部门报告;发生非预期停产的,在三日内报告所在地省级药品监督管理部门。必要时,向国家药品监督管理局报告。
制度5——责任赔偿制度
MAH应当具备法律要求的责任赔偿能力,建立责任赔偿的相关管理程序和制度,实行赔偿首负责任制。责任赔偿能力应当与产品的风险程度、市场规模和人身损害赔偿标准等因素相匹配。MAH应当具有责任赔偿能力相关证明或者相应的商业保险购买合同等。
制度6——年度报告制度
MAH应当建立年度报告制度。企业负责人应当指定专门机构或者人员负责年度报告工作,确保药品年度报告的信息真实、准确、完整和可追溯,符合法律法规及有关规定要求。报告撰写人员应当汇总上一个自然年度药品的生产销售、上市后研究、风险管理等情况,按照国家药品监督管理局制定的年度报告模板形成年度报告,经企业法定代表人或者企业负责人(或者其书面授权人)批准后向所在地省级药品监督管理部门报告。
制度7——自检管理制度
MAH应当建立自检管理相关制度,定期进行自检或者内审,监控药品生产质量管理规范、药品经营质量管理规范、药物警戒质量管理规范等实施情况。自检或者内审应当有方案、有记录,自检完成后应当形成自检报告,内容至少包括自检的基本情况、评价的结论以及纠正和预防措施的建议。
制度8——药品上市后变更控制相关制度
MAH应当建立药品上市后变更控制相关制度,建立药品上市后变更控制体系,制定实施内部变更分类原则、变更事项清单、工作程序和风险管理要求;应当结合产品特点,经充分研究、评估和必要的验证后确定变更管理类别,经批准、备案后实施或者在年度报告中载明。
制度9——双放行管理制度
药品生产企业应当建立药品出厂放行规程,明确出厂放行的标准、条件,并对药品质量检验结果、关键生产记录和偏差控制情况进行审核,对药品进行质量检验。符合有关标准、条件的,经质量受权人签字后方可出厂放行。
MAH应当履行药品上市放行责任,制定药品上市放行规程,审核受托生产企业制定的出厂放行规程,明确药品的上市放行标准,对药品生产企业出厂放行的药品检验结果和放行文件进行审核,符合有关规定的,经质量受权人签字后方可放行上市。必要时,持有人可对受托方药品生产记录、检验记录、偏差调查等进行审核。
参考文献
[1] www.nmpa.gov.cn
相 关 阅 读
《基于“MAH落实药品质量主体责任监督管理规定”的质量体系建设要点》
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。
【课程推荐】



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57