我国首部《药品召回管理办法》于2007年12月10日正式落地施行,随着2019年新修订《药品管理法》和《疫 苗管理法》的实施,MAH制度的落地,药品监管要求发生了很大变化。为适应新的监管要求,国家药监局启动了《药品召回管理办法》的修订。2022年10月26日,国家药监局发布《药品召回管理办法》(成文日期:2022年10月24日),自2022年11月1日起施行。本文对2022年版《药品召回管理办法》出台的背景、主要新增修订内容进行了分析。
一、新旧版《药品召回管理办法》基本框架结构变化
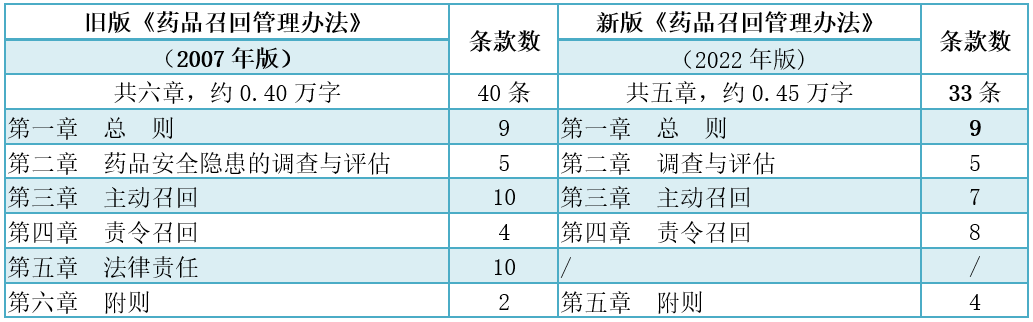
2022年版《药品召回管理办法》框架与2007年版基本保持一致,与旧版(2007年版)相比,2022年版条款总数减少了7条,第二章节将原"药品安全隐患的调查与评估"修改为"调查与评估";不设罚则章节,即全部删除旧版(2007年版)第五章法律责任。
二、新版《药品召回管理办法》主要新增修订内容抢先看
1. 修订了药品召回定义
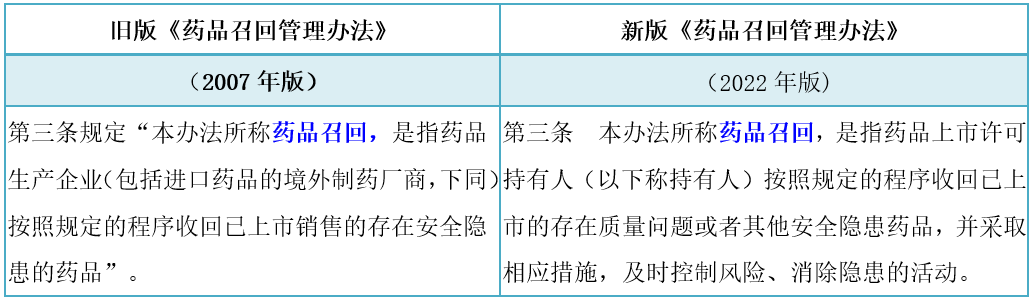
解读:药品召回定义根据2019年版《药品管理法》第82条规定,即:药品存在质量问题或者其他安全隐患的,药品上市许可持有人应当立即停止销售,告知相关药品经营企业和医疗机构停止销售和使用,召回已销售的药品,及时公开召回信息,必要时应当立即停止生产,并将药品召回和处理情况向省、自治区、直辖市人民政府药品监督管理部门和卫生健康主管部门报告。药品生产企业、药品经营企业和医疗机构应当配合。药品上市许可持有人依法应当召回药品而未召回的,省、自治区、直辖市人民政府药品监督管理部门应当责令其召回。新规将"已上市销售的存在安全隐患的药品"修改为"已上市的存在质量问题或者其他安全隐患药品",并增加了"并采取相应措施,及时控制风险、消除隐患的活动"。
2. 调整了药品召回的范围
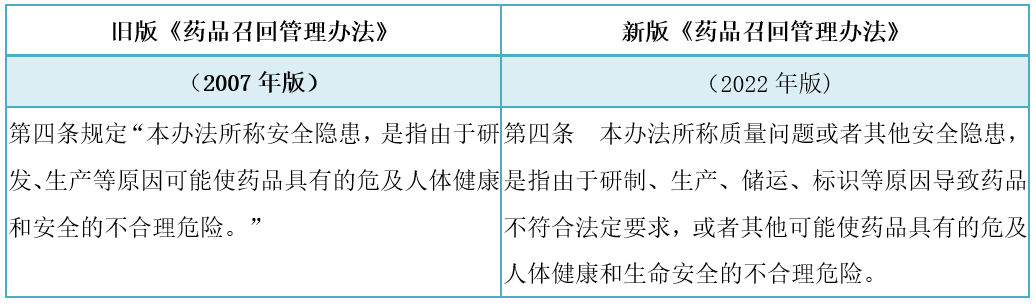
解读:由于标签标示、储运不当等原因可能存在影响药品安全或使用风险,根据实际需要召回的药品范围扩展为"质量问题或者其他安全隐患,是指由于研制、生产、储运、标识等原因导致药品不符合法定要求,或者其他可能使药品具有的危及人体健康和生命安全的不合理危险。"
3. 明确了药品召回信息公布的相关要求


解读:依据《药品管理法》相关规定,明确了MAH负责药品召回信息的公开;明确了药品监管部门对召回信息公布的相关要求。
4. 删除了药品召回相关法律责任条款

解读:不另设罚则。对于药品上市许可持有人责令其召回而拒不召回的,药品生产企业、药品经营企业、使用单位不配合召回的,按照《药品管理法》第一百三十五条的规定给予处罚。
5. 明确了药品召回记录相关要求
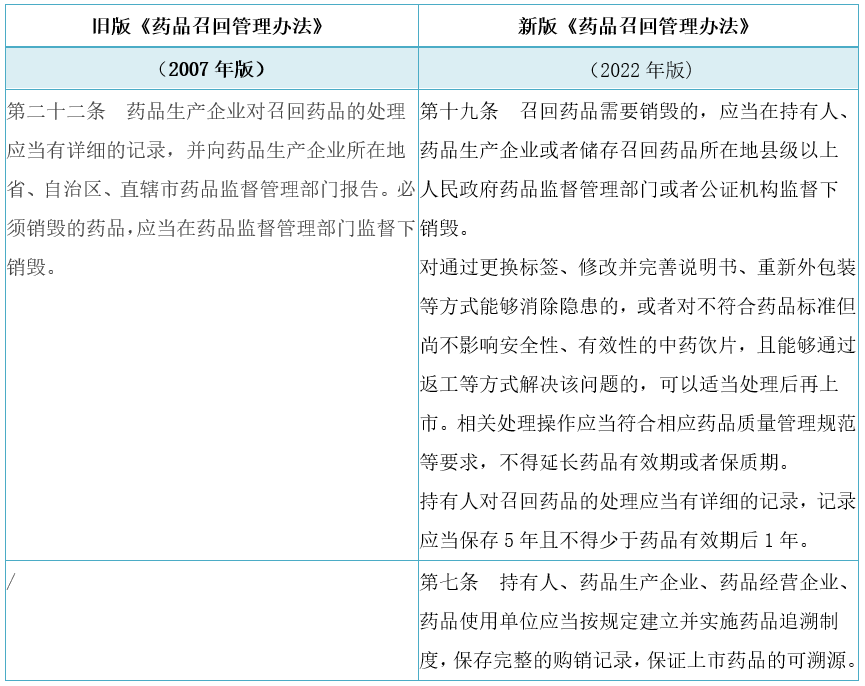
解读:增加了MAH可选择药品监管部门或者公证部门监督下销毁的方式,并明确了召回相关记录的保存期限,保证上市药品的可溯源。
参考文献
[1] www.nmpa.gov.cn



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57