欧盟作为全球三大医药市场之一,对于各国医药企业影响明显。因此,对于欧盟药品法规的学习和研究,一直是各国医药企业技术团队的工作重点之一。本文将依据EMA发布的2024年度工作计划来梳理和分析,阐释EMA2024年度工作重点。因为EMA既管理人药,也管理兽药;本文内容只涵盖人药工作计划部分。希望文本可以为意图进入欧盟市场的中国企业提供借鉴。
第一部分:批准产品可获得性工作计划
2022年,EMA和HMA联合发布《Work programme until 2025 of the HMA/EMA task force on availability of authorised medicines for human and veterinary use》R2.
根据这份工作计划,在2024年EMA需要完成的工作涵盖如下领域:
◆产品短缺供应方面
Improve cooperation on shortages and harmonization with international partners through implementation of guidance in the area of supply disruptions developed by ICMRA and the Global Regulators Working Group
通过实施ICMRA和全球监管机构工作组制定的供应中断领域指南,改善与国际伙伴在短缺和协调方面的合作。
◆法规交流
Review of practices following publication of good practice guide
在良好规范指南发布后审查规范文件。
第二部分:疫苗相关工作计划
20231204,EMA发布《Consolidated 3-year work plan for the Vaccine Working Party (VWP)》。
◆2024年优先发布的指南
《Guideline on Influenza Vaccines, Non-clinical and Clinical Module》;
流感疫苗非临床和临床指南;
《Interim guidance on enhanced safety surveillance for seasonal influenza vaccines in the EU》;
欧盟关于加强季节性流感疫苗安全监测的临时指南
《Addendum to the Guideline on clinical development of new vaccines》;
新疫苗临床开发指南附录
◆培训工作
根据工作进展,对欧盟疫苗评审员开展技术培训。
第三部分:非临床领域工作计划
20230126,EMA发布《Consolidated 3-year work plan for the Non-clinical domain including the priorities for 2023》。根据这份文件,2024年工作重点如下:
◆短期战略目标
• Consider more streamlined non-clinical development plan for other severely debilitating and life-threatening diseases beside cancer, without compromising human safety but in accordance with 3Rs.
考虑针对癌症以外的其他严重衰弱和危及生命的疾病制定更简化的非临床开发计划,但要符合3R。
• Ensure the follow-up and the identification of actions related to alternative to the use of non-human primates in line with the 3Rs and the identified shortage of non-human primates.
确保根据3R和已确定的非人灵长类动物短缺问题,采取后续行动并确定与替代使用非人灵长类动物有关的行动。
• Strengthen the interactions between non-clinical assessors and GLP inspectors in reviewing the GLP compliance of the non-clinical studies included in Marketing Authorisation Applications.
加强非临床评估员和GLP检查员之间的互动,以审查上市许可申请中包含的非临床研究的GLP合规性。
◆长期战略目标
• Implement/develop IT tools to exploit the added value of SEND for the re-analyses of non-clinical studies to support clinical trials, marketing authorisation and improved evidence generation.
实施/开发 IT 工具,以利用 SEND 的附加值对非临床研究进行重新分析,以支持临床试验、上市许可和改进证据生成。
• Adapt the GLP inspections methodology to new technologies, novel pre-clinical models including those adhering to the 3Rs and emergency health treats.
使GLP检查方法适应新技术、新的临床前模型,包括那些符合3R和紧急健康治疗的模型。
• Focus on harmonisation and coordination of GLP compliance assessment at EU level.
重点关注欧盟层面GLP合规评估的协调与合作。
◆需要起草指南
• ICH Q3E guideline for extractables and leachables (E&L)
参与起草ICH Q3E《浸出物和提取物指南》;
• Annex to guideline on 'Excipients in the labelling and package leaflet of medicines for human use': finalisation of the 4 drafts information for the package leaflet: dextrans, lactose, polysorbates and proline.
《人用药物标签及包装说明书的辅料》指引附件:包装说明书的4份资料草稿:葡聚糖、乳糖、聚山梨酯及脯氨酸的定稿文件。
• Revision of the procedure on GLP inspections coordination and requests.
修订GLP检查协调和请求程序。
• Development of a procedure for conducting EMA GLP inspections.
制定进行EMA GLP检查的程序。
• Development of a procedure on compliance checks on the basis of OECD guidance for receivers.
根据OECD对接收方的指导意见,制定遵守情况检查程序。
第四部分:传染病工作计划
20230126,EMA发布《Consolidated 3-year work plan for the Infectious Disease Working Party (IDWP)》。
◆指南修订工作
《Guideline on the clinical evaluation of antifungal agents for the treatment and prophylaxis of invasive fungal disease》;
抗真菌药物治疗和预防侵袭性真菌病的临床评价指南;
《Guideline on the clinical investigation of medicinal products for the treatment of cystic fibrosis》;
治疗囊性纤维化的医药产品临床研究指南;
◆培训工作
2024年将对如下领域培训作为重点:抗菌药物指南、PK-PD的使用和儿科开发领域。
第五部分:EMA整体工作计划
20231214,EMA发布《Final programming document 2024-2026》。根据这份文件,2024年工作重点如下:
◆产品上市前审评相关活动
主要涵盖如下技术领域:
Scientific advice and protocol assistance;
科学建议和方案协助
Supporting the development of PRIority Medicines;
支持治疗优先药物的开发
Orphan medicinal product designation and related maintenance procedures;
孤儿药产品名称及相关维护程序;
Development of medicines for children
研发儿童用药;
Classification and certification of advanced therapy medicinal products (ATMPs).
对ATMP药品进行分类和认定。
下图展示了2024年预计发生的工作任务量。
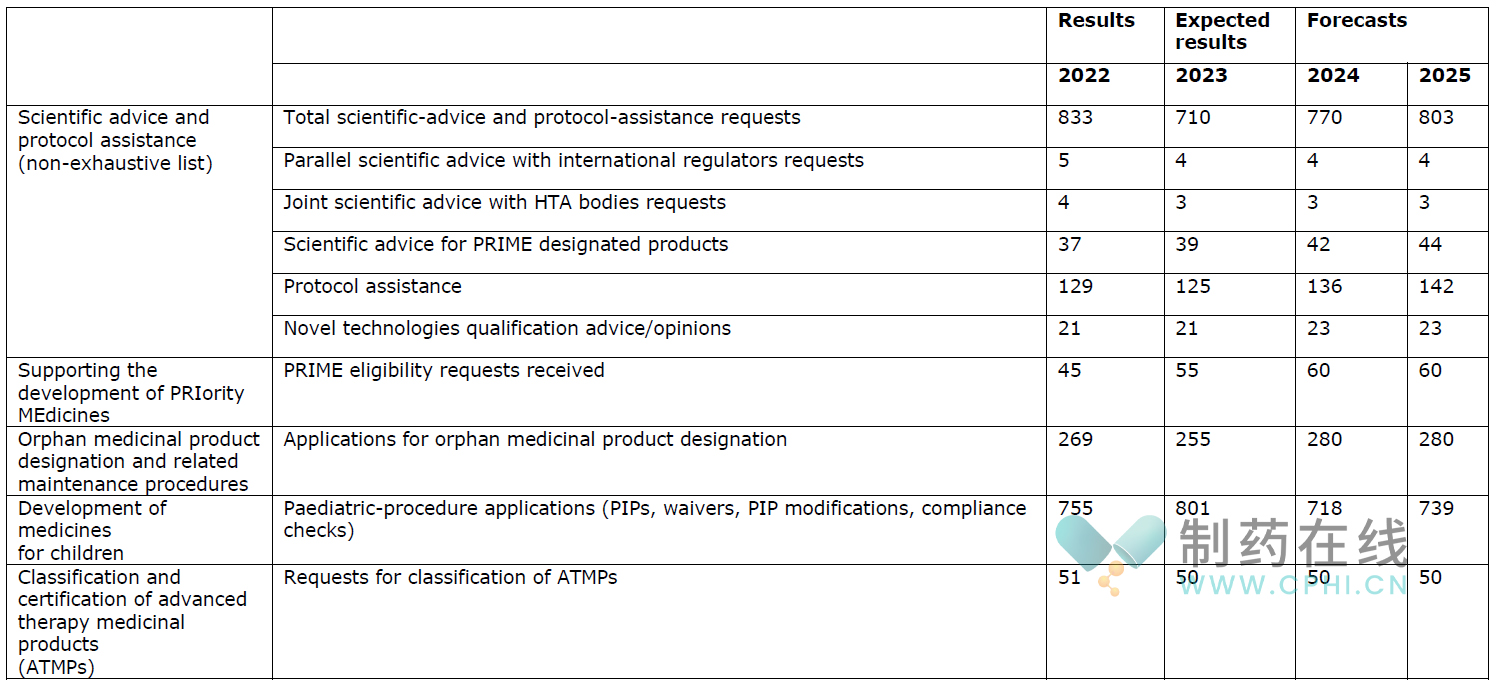
◆首次评估工作
下表介绍了预计2024年会发生的首次药品评估工作量。
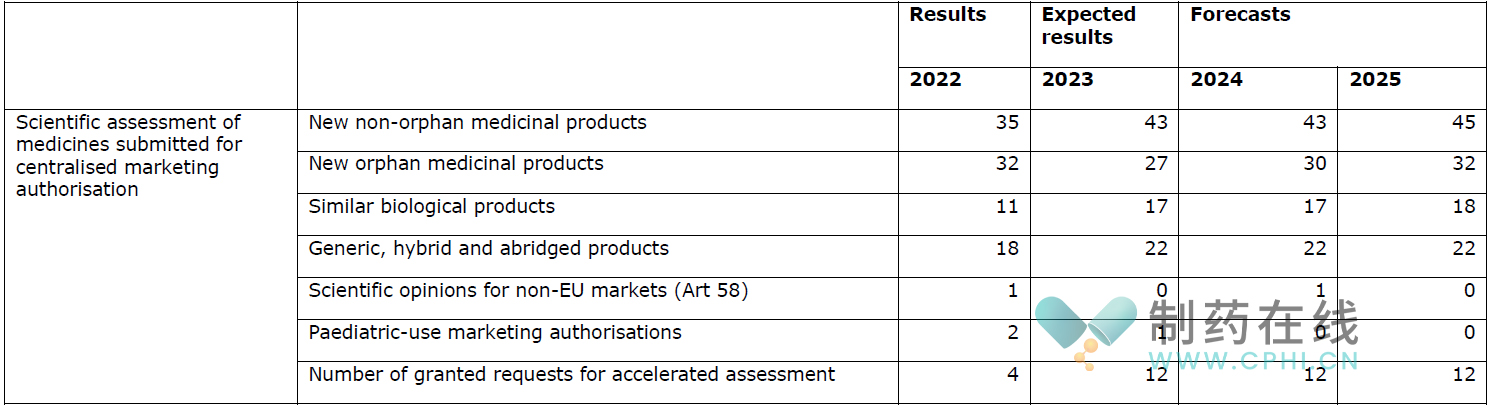

◆产品上市后审评工作
下表介绍了预计2024年将进行的药品上市后变更审评等工作量。
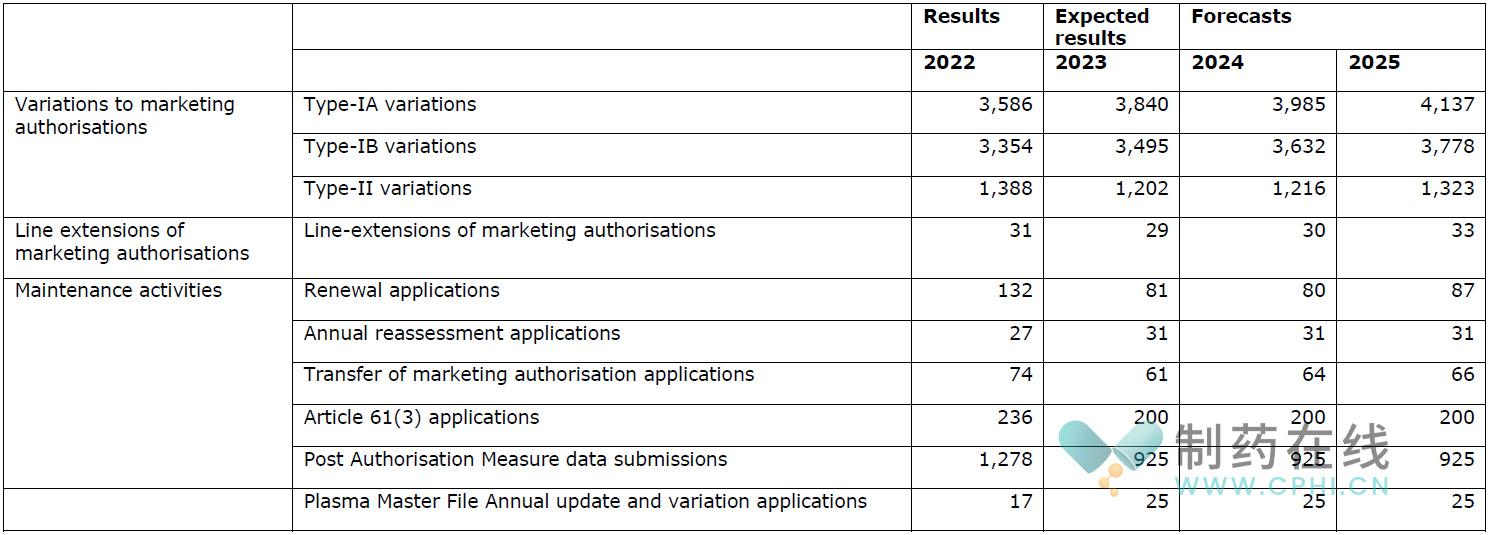
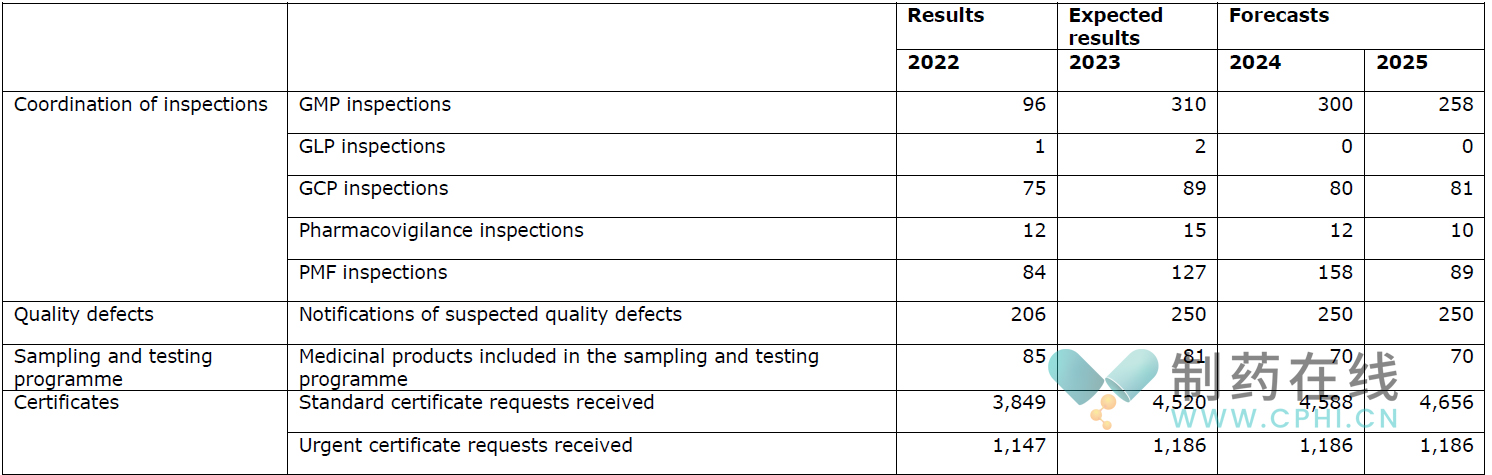
◆检查合规工作
下表介绍了2024年将启动的各类检查工作量。
第六部分:生物制品工作计划
20231206,EMA发布《3-year work plan for the Biologics Working Party》。根据这份文件,2024年工作重点如下:
◆指南制定工作
Reflection paper on the structure and properties for the determination of new active substance (NAS) status of biological substances;
关于确定生物物质新活性物质(NAS)状态的结构和性质的反思文件;
Questions and answers on BWP learnings;
关于BWP学习的问答;
Guideline on quality aspects of RNA vaccines;
RNA疫苗质量指南;
Guideline on the development and manufacture of human medicinal products specifically designed for phage therapy
噬菌体治疗专用人药产品开发和生产指南
PMF dossier requirements Questions and Answers
PMF申报资料要求问答指南
Guideline on Radiopharmaceuticals Based on Monoclonal Antibodies
基于单克隆抗体的放 射性药物指南
Guideline on epidemiological data on blood transmissible infections
血液传播感染流行病学数据指南
针对ICH相关指南,EMA将积极支持如下指南修订:ICH Q1对Q5的具体应用、Q3E、Q5A、Q6、M4Q(R2)等。
◆培训部分
EMA将在2024年开展针对AAV病毒的系统培训。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
相关阅读:
《龙年谈之二:2020-2023年中国企业欧盟认证情况梳理和趋势分析》




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57